题目内容
15.在液晶显示器工业中广泛应用一种有机物分子 对羟基肉桂酸,它是一种强效的导电材料,结构简式如图: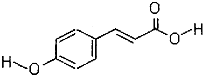
①该有机物的分子中所含官能团的名称酚羟基、碳碳双键、羧基.
②该有机物能发生的反应类型是(填写代号)AC.
A.氧化反应 B.消去反应 C.加聚反应 D.水解反应
③一定条件下,1mol该有机物分子与溴水完全反应时,最多需要3mol Br2.
分析 由结构可知,分子中含酚-OH、碳碳双键、-COOH,结合酚、烯烃、羧酸的性质来解答.
解答 解:①该有机物的分子中所含官能团的名称为酚羟基、碳碳双键、羧基,故答案为:酚羟基、碳碳双键、羧基;
②A.含-OH、碳碳双键可发生氧化反应,故A选;
B.酚-OH不能发生消去反应,故B不选;
C.含碳碳双键,可发生加聚反应,故C选;
D.不含能水解的官能团,不能发生水解反应,故D不选;
故答案为:AC;
③酚-OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则一定条件下,1mol该有机物分子与溴水完全反应时,最多需要3mol Br2,故答案为:3.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃的性质及应用,题目难度不大.

练习册系列答案
相关题目
4.国际元素相对原子量表上查得N是14.01,这是指氮的( )
| A. | 平均相对原子质量 | B. | 相对原子质量 | ||
| C. | 质量数 | D. | 同位素相对原子质量 |
6.下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是( )
| A. | Na+、Ca2+、SO42-、CO32- | B. | K+、Ca2+、HCO3-、Cl- | ||
| C. | K+、Al3+、SO42-、NO3- | D. | K+、Na+、CO32-、SO42- |
3.下列关于化学反应速率的说法正确的是( )
| A. | 1 L 0.1 mol•L-1盐酸和1 L 0.1 mol•L-1硫酸分别与1 L 2 mol•L-1 NaOH溶液反应速率相同 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1,其含义是时间为1s时,某物质的浓度是0.8 mol•L-1 | |
| C. | 0.1 mol•L-1盐酸和0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
10.乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂不正确的是( )
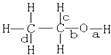

| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和浓硫酸共热至170℃时键b和d断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和氢溴酸反应键a断裂 |
7.下列叙述中,正确的是( )
| A. | 苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃形成悬浊液 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以和NaHCO3反应放出CO2 | |
| D. | 苯酚也可以与硝酸发生硝化反应 |
4.下列判断正确的是( )
| A. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| B. | 将80 g SO3溶于水并配成1 L溶液,溶质的物质的量浓度为1 mol•L-1 | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 1 mol•L-1 NaCl溶液含有NA个Na+ |
5.下列有关化学实验的操作或说法中,正确的是( )
| A. | 甘油、油脂均能使酸性KMnO4溶液褪色 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硝酸进行酸化,再加硝酸银溶液,观察现象 | |
| C. | 淀粉水解程度的检验要用到的试剂有:碘水、氢氧化钠、新制氢氧化铜 | |
| D. | 制溴苯应用液溴、铁屑和苯混合,反应中可观察到容器中有大量白色雾气 |
 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;