题目内容
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:

(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
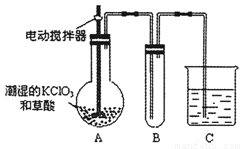
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1 KMnO4 溶液滴定至终点,重复两次,平均消耗KMnO4 溶液16.00 mL。
①如何判断滴定终点? ,
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为 ,
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


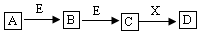 (部分生成物和反应条件略去)。下列推断错误的是( )
(部分生成物和反应条件略去)。下列推断错误的是( )