题目内容
3.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的过程如下: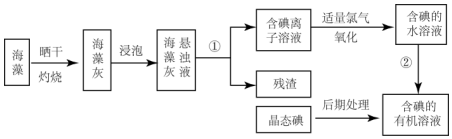
请填写下列空白:
(1)灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是BDEF(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.瓷坩埚 C.表面皿 D.泥三角 E.酒精灯 F.坩埚钳
(2)指出提取碘的过程中有关的实验操作名称:①过滤、②萃取分液.
(3)提取碘的过程中,以下有机溶剂不能使用的是A(填编号),其原因是酒精易溶于水,不能分层.
A.酒精 B.苯 C.汽油
该提取操作通常在分液漏斗(仪器名称)中进行,若得到的是含碘的四氧化碳溶液,静置后分层,下层为紫红色.
(4)“加碘食盐”中的碘主要以碘酸钾形式存在,其中碳元素的化合化是+5.测定“加碘食盐”中碘元素含量的一种方法如下:称取50.0g食盐溶于适量水,加入过量碘化钾和稀硫酸,其反应的化学方程式为:
1KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O
①配平上述方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+H2O.
②该反应中被氧化的元素与被还原的元素的质量比为5:1.
分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘,
(1)根据实验操作步骤①为灼烧来分析用到的实验仪器,灼烧海带时,所用到的仪器除需要泥三角除酒精灯和泥三角外,还需要坩埚盛放海带;
(2)分离固体和液体用过滤,将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)碘酸钾中氧元素是-2价,钾元素是+1价,化合物中元素的化合价的代数和为零,该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,KI为还原剂,一个KI失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,
①根据氧化还原反应中得失电子数相等配平,元素化合价升高的为还原剂;
②-1价碘元素被氧化.+5价碘元素被还原;
解答 解:(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,
故答案为:BDEF;
(2)将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法.将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取,故答案为:过滤;萃取分液;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的是汽油或苯,酒精易溶于水,不能分层,不能用酒精做萃取剂,萃取分液操作在分液漏斗中进行,若得到的是含碘的四氧化碳溶液,静置后分层,四氯化碳为不溶于水比水重的有机溶剂,静置后分层,四氯化碳在下层为紫红色,
故答案为:A;酒精易溶于水,不能分层;分液漏斗;紫红;
(4)化合物中元素的化合价的代数和为零.化合物中钾元素常显+1价,氧元素常显-2价,设碘酸钾中碘元素的化合价为x.则(+1)+x+(-2)×3=0,x=+5,该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,KI为还原剂,一个KI失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,得到化学方程式为:KIO3+5KI+3H2SO4=3K2SO4+3I2+H2O,
故答案为:+5;1、5、3、3、3、3;KI;
①配平上述方程式为:KIO3+5KI+3H2SO4=3K2SO4+3I2+H2O,
故答案为:KIO3+5KI+3H2SO4=3K2SO4+3I2+H2O;
②分析可知该反应中被氧化的元素与被还原的元素的质量比为5:1,
故答案为:5:1.
点评 本题考查制备实验方案的设计、实验室里从海藻中提取碘、氧化还原反应配平,涉及到的知识点较多,掌握碘元素的有关知识及其计算是解答的关键,题目难度中等,注意基本实验操作的要点和注意事项.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
H2S(g)+O2(g)=S(g)+H2O(g)△H3
2S(g)=S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |
| A. | HCl | B. | CO(NH2)2 | C. | CO2 | D. | H2O |
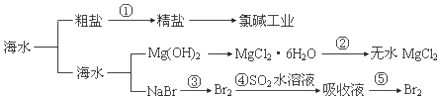
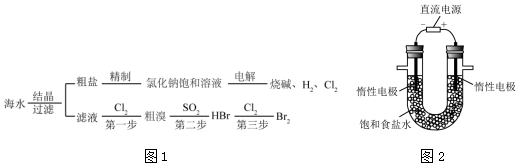
| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 工业生产中常选用石灰乳作为 Mg2+的沉淀剂 | |
| C. | 第②步的反应条件是:在空气中直接加热 | |
| D. | 第③步到第⑤步的目的是为了富集溴元素 |
| A. | 燃煤时鼓入过量的空气可以减少酸雨的产生 | |
| B. | 利用汽车尾气催化装置可将尾气中的NO和CO转化为无害气体 | |
| C. | “煤改气”、“煤改电”等工程有利于减少雾霾 | |
| D. | 工业废气排放之前必须回收处理以防污染大气 |
| A. | 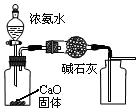 用图装置制取并收集干燥纯净的NH3 | |
| B. |  用图装置可以完成“喷泉”实验 | |
| C. | 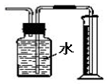 用图装置直接测量Cu与浓硝酸反应产生的NO2体积 | |
| D. | 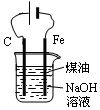 用图装置制备Fe(OH)2并能较长时间观察其颜色 |
| A. |  图是除去水中泥沙 | B. |  图是配制0.100 mol/L稀硫酸 | ||
| C. |  图是点燃酒精灯 | D. |  图是检查装置的气密性 |
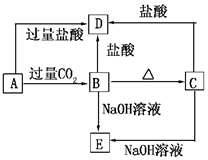 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).