题目内容
元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分: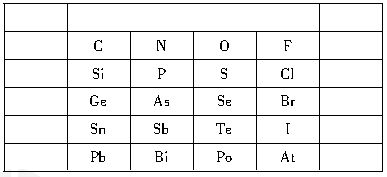
(1)一般地,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列对同主族元素所组成的物质的性质的推理中不正确的是______。
A.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
B.Cl2能置换出NaBr溶液中的溴,故Br2也能置换出KI溶液中的碘
C.Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
(2)表中P元素原子的电子排布式为_________;As的原子结构示意图是__________________。
(3)根据元素周期律,请你预测:
H3AsO4、H3PO4的酸性强弱:________>_______;As、Se气态氢化物的稳定性:________>________。
(4)比较N和O的第一电离能的大小:________>______,原因是______________________________。
(1)CD (2)1s22s22p63s23p3;

(3)H3PO4;H3AsO4;H2Se;AsH3
(4)I1(N);I1(O);由N原子的电子排布式1s22s22p3知,其2p轨道为半充满的稳定状态,故失去一个电子需要的能量较高
【试题分析】

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体。
|
单质 |
a |
b |
c |
d |
e |
|
沸点(℃) |
58.8 |
882.9 |
444.7 |
2 355 |
1 107 |
(1) a的元素在元素周期表中的位置为________。
(2) 写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类型),溶于强碱的离子方程式为________________________________________。
(3) c与氢形成的分子X的空间构型为________;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式___________________________________。
(4) 上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为____________________________。
(5) b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是________。
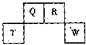 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2