题目内容
关于如图所示装置的叙述,正确的是( )


| A、氢离子在铜片表面被还原 |
| B、铜片质量逐渐减少 |
| C、电流从锌片经导线流向铜片 |
| D、铜是负极,铜片上有气泡产生 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中,Zn易失电子作负极、Cu作正极,负极上金属失电子发生氧化反应、正极上氢离子放电生成氢气,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,电流从正极沿导线流向负极.
解答:
解:A.正极是Cu,正极反应式为2H++2e-=H2↑,所以氢离子在铜片表面得电子发生还原反应,被还原,故A正确;
B.铜片上氢离子得电子生成氢气,所以铜片质量不变,故B错误;
C.电流从正极Cu沿导线流向负极Zn,故C错误;
D.Zn易失电子作负极、Cu作正极,故D错误;
故选A.
B.铜片上氢离子得电子生成氢气,所以铜片质量不变,故B错误;
C.电流从正极Cu沿导线流向负极Zn,故C错误;
D.Zn易失电子作负极、Cu作正极,故D错误;
故选A.
点评:本题考查原电池原理,侧重考查学生分析问题能力,明确原电池正负极的判断、正负极反应及电流流向即可解答,题目难度不大.

练习册系列答案
相关题目
下列关于葡萄糖的说法错误的是( )
| A、葡萄糖的分子式是C6H12O6 |
| B、葡萄糖属于单糖 |
| C、葡萄糖是碳水化合物,因为它的分子是由6个碳原子和6个水分子组成 |
| D、葡萄糖能与新制的氢氧化铜悬浊液共热反应,生成砖红色的沉淀 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
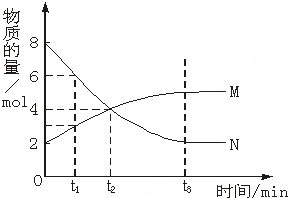

| A、反应的化学方程式为:M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t1时,N的浓度是M浓度的2倍 |
国家“十二五规划”中明确提出了节能减排的目标,以下做法不符合节能减排的是( )
| A、在钢铁等高耗能行业发展余热余压利用工程 |
| B、以煤炭气化替代燃料油和原料油的使用 |
| C、用第四代LED绿色光源替代白炽灯 |
| D、使用冰箱时,尽可能在冰箱内装满食物 |
下列物质中,属于电解质的是( )
| A、醋酸溶液 | B、蔗糖 |
| C、AgCl | D、盐酸溶液 |
在固定体积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程某一时刻SO2、O2、SO3浓度(mol/L)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
| A、SO2为0.25mol/L |
| B、SO2,O2分别为0.4,0.2mol/L |
| C、SO2,SO3均为0.15mol/L |
| D、SO3为0.4mol/L |
有A、B、C、D、E、F六种元素,其中A、B、C、D、E为原子序数依次增大的短周期元素.已知:①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的电子层数:B=C=2A;④B元素的最高正价与最低负价的绝对值之差为2;⑤F为地壳中含量第二的金属元素.下列说法正确的是( )
| A、B的氧化物对应水化物为强酸 |
| B、F单质与C单质反应的产物只有一种 |
| C、因为E单质的相对分子质量小于溴单质的相对分子质量,所以E单质的熔点比溴单质要低 |
| D、A、D形成的化合物的水溶液呈碱性 |
下列化学方程式或离子方程式,书写规范、正确的是(反应条件略)( )
A、 |
B、 |
C、苯酚钠溶液中通入少量二氧化碳的离子方程式: +H2O+CO2→ +H2O+CO2→ +HCO3- +HCO3- |
| D、乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O |
