题目内容
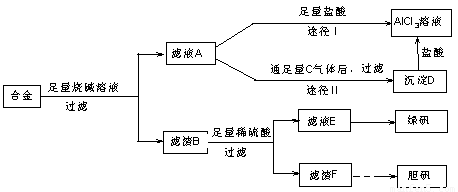
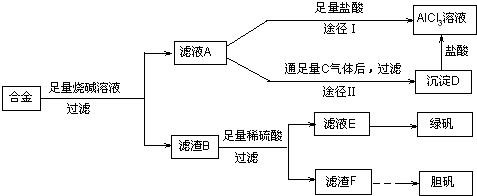
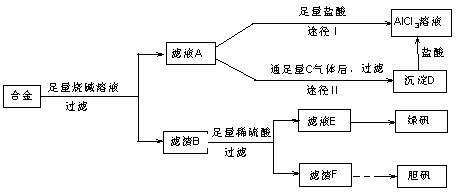
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:

回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式________.
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是________.上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有________和玻璃棒;其中玻璃棒的作用是________.
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是________、________.
(4)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、________、冷却结晶、________、自然干燥.其中“加热通氧气”所起的作用为________(用离子方程式表示).
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量.此变化的化学方程式为:CuSO4·xH2O![]() CuSO4+xH2O,但温度过高,CuSO4会继续分解为CuO和SO3.在此实验过程中,称量操作至少进行________次.若测定结果x值偏高,可能的原因是________.
CuSO4+xH2O,但温度过高,CuSO4会继续分解为CuO和SO3.在此实验过程中,称量操作至少进行________次.若测定结果x值偏高,可能的原因是________.
a.加热温度过高
b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却
d.所用坩埚事先未干燥(潮湿)
解析:
|
(1)2Al+2OH-+2H2O (2)途径②(2分);烧杯、漏斗(2分);引流(1分) (3)产生等量胆矾途径④消耗硫酸少(1分) 途径④不会产生污染大气的气体(1分) (4)蒸发浓缩(1分) 过滤(1分) 2Cu+O2+4H+ (5)4(2分) abd(3分) |

 字词句段篇系列答案
字词句段篇系列答案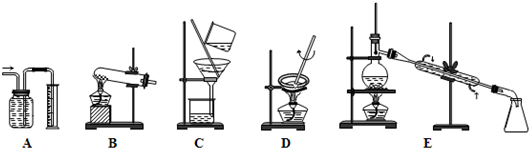

 。
。