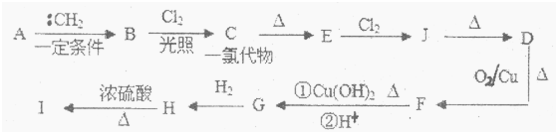
题目内容
X、Y、Z、R、W为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.请回答下列问题:
(1)X的氢化物与R的氢化物相遇,生成物中存在的化学键类型有 .W在元素周期表中的位置为 .
(2)XY3-离子的立体构型是 ;ZY42-中的一个Y原子被Z替换后形成Z2Y32-,则Z2Y32-离子中心原子的杂化轨道类型为 .
(3)已知:氢气、Z的固态单质、气态J的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,则气态J分解生成固态Z和氢气的热化学方程式为 .
(4)在酸性溶液中,WY4-能被Q还原为W2+,该反应的离子方程式是 .
(1)X的氢化物与R的氢化物相遇,生成物中存在的化学键类型有
(2)XY3-离子的立体构型是
(3)已知:氢气、Z的固态单质、气态J的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,则气态J分解生成固态Z和氢气的热化学方程式为
(4)在酸性溶液中,WY4-能被Q还原为W2+,该反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、R、W为前四周期元素且原子序数依次增大,X的单质与Y的单质在放电条件下反应产生大气污染物NO,则X是N、Y是O元素;
R基态原子的M能层上有3对成对电子,则R是Cl元素;
W核外有5个未成对电子,则W是Mn元素;
Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素;
(1)X的氢化物是氨气、R的氢化物是HCl,二者相遇生成氯化铵,氯化铵中含有离子键、共价键;Mn元素在元素周期表中的位置为第四周期第ⅦB族;
(2)根据价层电子对互斥理论确定NO3-立体构型;SO42-中的一个O原子被S替换后形成S2O32-,硫酸根离子和硫代硫酸根离子互为等电子体,根据硫酸根离子中S原子价层电子对互斥理论确定S2O32-离子中心原子的杂化轨道类型;
(3)氢气、S(s)、气态H2S的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,根据燃烧热计算其反应热,写出相应的热化学方程式;
(4)在酸性溶液中,MnO4-能被H2O2还原为Mn2+,双氧水被氧化生成氧气.
R基态原子的M能层上有3对成对电子,则R是Cl元素;
W核外有5个未成对电子,则W是Mn元素;
Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素;
(1)X的氢化物是氨气、R的氢化物是HCl,二者相遇生成氯化铵,氯化铵中含有离子键、共价键;Mn元素在元素周期表中的位置为第四周期第ⅦB族;
(2)根据价层电子对互斥理论确定NO3-立体构型;SO42-中的一个O原子被S替换后形成S2O32-,硫酸根离子和硫代硫酸根离子互为等电子体,根据硫酸根离子中S原子价层电子对互斥理论确定S2O32-离子中心原子的杂化轨道类型;
(3)氢气、S(s)、气态H2S的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,根据燃烧热计算其反应热,写出相应的热化学方程式;
(4)在酸性溶液中,MnO4-能被H2O2还原为Mn2+,双氧水被氧化生成氧气.
解答:
解:X、Y、Z、R、W为前四周期元素且原子序数依次增大,X的单质与Y的单质在放电条件下反应产生大气污染物NO,则X是N、Y是O元素;
R基态原子的M能层上有3对成对电子,则R是Cl元素;
W核外有5个未成对电子,则W是Mn元素;
Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素;
(1)X的氢化物是氨气、R的氢化物是HCl,二者相遇生成氯化铵,氯化铵中铵根离子和酸根离子之间存在离子键、N原子和H原子之间存在共价键;Mn元素在元素周期表中的位置为第四周期第ⅦB族,
故答案为:离子键、共价键;第四周期第ⅦB族;
(2)NO3-中N原子价层电子对个数是3且不含孤电子对,所以为平面三角形;SO42-中的一个O原子被S替换后形成S2O32-,硫酸根离子和硫代硫酸根离子互为等电子体,硫酸根离子中S原子价层电子对个数是4且不含孤电子对,所以硫酸根离子中S原子杂化方式为sp3杂化,则硫代硫酸根离子中S原子杂化方式为sp3杂化,
故答案为:平面三角形;sp3杂化;
(3)氢气、S(s)、气态H2S的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,H2S分解时△H=285.8 kJ/mol+296.8 kJ/mol-562.0 kJ/mol=+20.6 kJ/mol,
所以其热化学方程式为H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol,
故答案为:H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol;
(4)在酸性溶液中,MnO4-能被H2O2还原为Mn2+,双氧水被氧化生成氧气,离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
R基态原子的M能层上有3对成对电子,则R是Cl元素;
W核外有5个未成对电子,则W是Mn元素;
Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素;
(1)X的氢化物是氨气、R的氢化物是HCl,二者相遇生成氯化铵,氯化铵中铵根离子和酸根离子之间存在离子键、N原子和H原子之间存在共价键;Mn元素在元素周期表中的位置为第四周期第ⅦB族,
故答案为:离子键、共价键;第四周期第ⅦB族;
(2)NO3-中N原子价层电子对个数是3且不含孤电子对,所以为平面三角形;SO42-中的一个O原子被S替换后形成S2O32-,硫酸根离子和硫代硫酸根离子互为等电子体,硫酸根离子中S原子价层电子对个数是4且不含孤电子对,所以硫酸根离子中S原子杂化方式为sp3杂化,则硫代硫酸根离子中S原子杂化方式为sp3杂化,
故答案为:平面三角形;sp3杂化;
(3)氢气、S(s)、气态H2S的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,H2S分解时△H=285.8 kJ/mol+296.8 kJ/mol-562.0 kJ/mol=+20.6 kJ/mol,
所以其热化学方程式为H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol,
故答案为:H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol;
(4)在酸性溶液中,MnO4-能被H2O2还原为Mn2+,双氧水被氧化生成氧气,离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
点评:本题考查位置结构性质相互关系及应用,涉及氧化还原反应、热化学方程式的书写、原子杂化、化学键等知识点,综合性较强,正确推断元素、物质是解本题关键,同时考查学生知识迁移能力,知道硫代硫酸根离子中S原子杂化方式判断,为易错点.

练习册系列答案
相关题目
下列化学用语表示正确的是( )
A、H2O、Na2O的电子式都可用 表示 表示 |
B、Cl、Br、I的+1价含氧酸的结构式都可用“ ”表示 ”表示 |
| C、乙酸、乙酸乙酯、葡萄糖的分子式都可用“CnH2nOn”表示 |
| D、碳酸、亚硫酸的电离方程式都可用“H2XO3?2H++XO32-”表示 |
下列各元素原子排列中,按其半径逐渐增大,电负性逐渐减小顺序排列正确的是( )
| A、K、Na、Li |
| B、F、O、S |
| C、As、P、N |
| D、C、N、O |
下列离子方程式与所述事实相符且正确的是( )
| A、向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、用稀硝酸清洗银镜反应实验后的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
| D、钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
 阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为: