题目内容
在17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0mol?L-1、c(N2O4)=0.012 0mol?L-1 现用一定量的Cu与足量的浓HNO3 反应,制得上述1.00L已达到平衡的N2O4 和NO2 的混合气体(17℃、1.01×105 Pa),理论上至少需消耗Cu多少克?
考点:有关混合物反应的计算
专题:
分析:根据n=cV计算出N2O4和NO2的物质的量,根据反应方程式计算Cu的物质的量,根据m=nM计算理论上消耗Cu的质量.
解答:
解:平衡时,c(NO2)=0.030 0mol?L-1、c(N2O4)=0.012 0mol?L-1,
n(N2O4)=c(N2O4)×V=0.0120 mol?L-1×1.00L=0.0120mol,
n(NO2)=c(NO2)×V=0.0300 mol?L-1×1.00L=0.0300mol,
则生成二氧化氮总的物质的量为:n (NO2)总=n(NO2)+2n(N2O4)=0.0540mol,
由Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可得
m=
×64g/mol=1.73g,
答:理论上需消耗Cu的质量为1.73g.
n(N2O4)=c(N2O4)×V=0.0120 mol?L-1×1.00L=0.0120mol,
n(NO2)=c(NO2)×V=0.0300 mol?L-1×1.00L=0.0300mol,
则生成二氧化氮总的物质的量为:n (NO2)总=n(NO2)+2n(N2O4)=0.0540mol,
由Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可得
m=
| 0.0540mol |
| 2 |
答:理论上需消耗Cu的质量为1.73g.
点评:本题考查了有关混合物反应的计算,题目难度中等,明确反应原理为解答关键,注意质量守恒定律、电子守恒等知识在化学计算中的应用方法.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
有关物质用途,用离子方程式解释不正确的是( )
| A、氢氟酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O |
| B、明矾用于净水:Al3++3H2O=Al(OH)3+3H+ |
| C、纯碱去除油污:CO32-+H2O?HCO3-+OH- |
| D、氯气制备“84”消毒液:Cl2+2OH-=Cl-+ClO-+H2O |
如图所示滴定前后滴定管中液面所处的刻度,则消耗溶液的体积为( )


| A、V1 mL |
| B、V2mL |
| C、(V1-V2)mL |
| D、(V2-V1)mL |
属于CH4 的同系物是( )
| A、C2H6 |
B、 |
| C、CH2=CH2 |
| D、CH3OH |
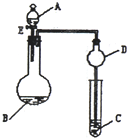 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
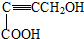 是重要的化工原料,其合成过程如下:
是重要的化工原料,其合成过程如下: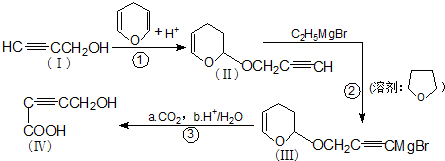
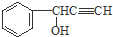 )与
)与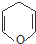 发生反应的方程式为
发生反应的方程式为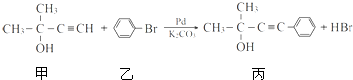
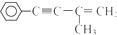 的反应条件是
的反应条件是