题目内容
5.锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用.(1)金属锰可用铝热法制得.已知Al的燃烧热为ckJ•mol-1,其余相关热化学方程式为:
3MnO2(s)═Mn3O4(s)+O2(g)△H1=akJ•mol-1
3Mn3O4(s)+8Al(s)═9Mn(s)+4Al2O3(s)△H2=bkJ•mol-1
则3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s)△H=(a+$\frac{1}{3}$b-$\frac{4}{3}$c)kJ•mol-1(用含a、b、c的代数式表示)
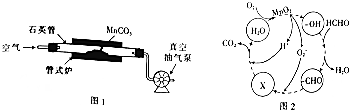
(2)MnCO3广泛用作锰盐原料.通过图1装置焙烧MnCO3可以制取MnO2,反应方程式为:
2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g).
①2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)的化学平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$.
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还能使平衡正向移动,提高MnCO3的转化率.
(3)MnSO2常用作催化剂.MnO2催化降解甲醛的反应机理如图2所示,图中X表示的粒子是HCO3-,该反应的总反应方程式为HCHO+O2$\frac{\underline{\;MnO_{2}\;}}{\;}$CO2+H2O.
(4)MnSO4是重要微量元素肥料.用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为Mn2++2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+H2↑+2H+,电解过程中阴极附近的pH增大(选填“增大”、“减小”或“不变”)
分析 (1)已知:①.3MnO2(s)═Mn3O4(s)+O2(g)△H1=akJ•mol-1
②.3Mn3O4(s)+8Al(s)═9Mn(s)+4Al2O3(s)△H2=bkJ•mol-1
由Al的燃烧热可得:③.Al(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=c kJ•mol-1,
根据盖斯定律,①+$\frac{1}{3}$×②+$\frac{4}{3}$×③可得:3MnO2(s)=Mn3O4(s)+O2(g),反应热也进行相应的计算;
(2)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动;
(3)氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,阴极发生还原反应,水放电生成氢气(还会生成氢氧根离子),配平书写电极反应式.
解答 解:(1)已知:①.3MnO2(s)=Mn3O4(s)+O2(g)△H1=a kJ•mol-1
②.3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s)△H2=b kJ•mol-1
由Al的燃烧热可得:③.Al(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=-c kJ•mol-1,
根据盖斯定律,①+$\frac{1}{3}$×②+$\frac{4}{3}$×③可得:3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s),则△H=(a+$\frac{1}{3}$b-$\frac{4}{3}$c) kJ•mol-1,
故答案为:a+$\frac{1}{3}$b-$\frac{4}{3}$c;
(2)①2MnCO3(s)+O2(g)?2MnO2(s)+2CO(g)的化学平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$;
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动,可提高MnCO3的转化率,
故答案为:使平衡正向移动,提高MnCO3的转化率;
(3)氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水,可得该反应的总反应方程式为:HCHO+O2$\frac{\underline{\;MnO_{2}\;}}{\;}$CO2+H2O,
故答案为:HCO3-;HCHO+O2$\frac{\underline{\;MnO_{2}\;}}{\;}$CO2+H2O;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,阴极水得电子发生还原反应生成氢气,总反应离子方程式为:Mn2++2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+H2↑+2H+,阴极附近氢氧根浓度增大,则电解过程中阴极附近的pH增大,
故答案为:Mn2++2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+H2↑+2H+;增大.
点评 本题考查盖斯定律计算反应热、化学平衡常数及影响因素、电解原理等,侧重考查学生对知识迁移运用,难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | CH≡CH+2Br2→CHBr2-CHBr2 | B. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | ||
| C. |  +HCN$\stackrel{催化剂}{→}$ +HCN$\stackrel{催化剂}{→}$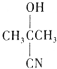 | D. | CH3COOH+NH3$\stackrel{△}{→}$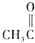 -NH2+H20 -NH2+H20 |
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 氧原子的结构示意图: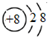 | |
| C. | 过氧化氢的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
| 装置 | 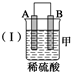 | 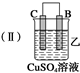 | 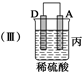 |
| 现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| A. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 0.1mol•L-1Na2CO3与0.05mol•L-1NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | Na2S溶液中:c(OH-)═c(H+)+c(HS-)+2c(H2S) |
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃l0mL 5mol/L的X溶液 | ||
| C. | 20℃30mL 2mol/L的X溶液 | D. | 10℃l0mL2mol/L的X溶液 |
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |
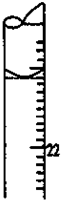 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: