题目内容
4.某同学组装了如图所示的电化学装置,则下列说法正确的是( )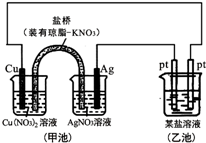
| A. | 图中甲池为原电池装置,电子从铜电极通过溶液和盐桥流向Ag电极 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变 | |
| D. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液不可能是AgNO3溶液 |
分析 甲池为原电池装置,活泼的铜失电子作负极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,铜放电生成铜离子,盐桥中的阴离子硝酸根离子向左边移动,如果用铜制U形物代替“盐桥”,甲池中的右边一个池为原电池装置,据此分析解答.
解答 解:A、图中甲池为原电池装置,Cu电极为负极发生氧化反应,电子不经过电解质溶液,故A错误;
B、实验过程中,铜放电生成铜离子,盐桥中的阴离子硝酸根离子向左边移动,所以左侧烧杯中NO3-的浓度变大,故B错误;
C、用铜制U形物代替“盐桥”,右边铜的质量减少,而左边铜的质量增加,而整个电路转移电子数相等,所以减少的质量与增加的质量相等,U型管的质量不变,故C正确;
D、若甲池中Ag电极质量增加5.4g时,即生成银5.4g,物质的量为$\frac{5.4}{108}$=0.05mol,所以整个电路转移0.05mol的电子,如果硝酸银足量应生成5.4g的银,如果是硝酸银说明硝酸银不足,所以可能是AgNO3溶液,故D错误;
故选C.
点评 本题考查了原电池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.

练习册系列答案
相关题目
14.实验室用NaOH固体配制250mL 1mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1mol/L的NaOH溶液
(2)容量瓶上标有以下五项中的①③⑤;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)B→C→A→F→E→D;
A、用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(4)下列配制的溶液浓度偏低的是BC;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水.
(1)配制250mL 1mol/L的NaOH溶液
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)B→C→A→F→E→D;
A、用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(4)下列配制的溶液浓度偏低的是BC;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水.
15.下列有机物分子中,所有原子都处于同一平面的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙烷 | D. | 乙醇 |
12.下列叙述正确的是( )
| A. | 1mol奥沙拉嗪( ) 与足量Na2CO3溶液反应能生成4molC O2B ) 与足量Na2CO3溶液反应能生成4molC O2B | |
| B. | 已知反应mX(g)+nY(g)?qZ(g),若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1 | |
| C. | 1L 1mol/LNa2CO3溶液中含有3×6.02×1023个离子 | |
| D. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol•L-1和是1.0×10-bmol•L-1,在此温度时,水的离子积为1.0×10-(b+a) |
19.下列说法正确的是( )
| A. | 屠呦呦女士通过研究青蒿素获得了“诺贝尔医学奖”以表彰她对疟疾治疗所做的贡献.那么青蒿素的结构式为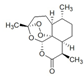 ,分子式为C15H20O5 ,分子式为C15H20O5 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 淀粉,纤维素,油脂均能发生水解,同时它们都是高分子化合物 | |
| D. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 |
9.已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,该溶液中含氮、含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )
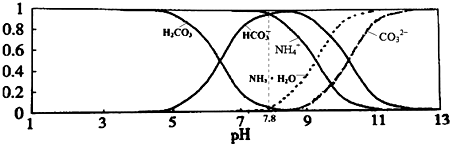

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+浓度逐渐减小,HCO3-浓度先增大后减小 | |
| D. | 通过分析可知常温下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
16.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1L 0.1mol•L-1的氨水含有0.1 NA个OH- | |
| B. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| C. | 80℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+ | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32g铜时转移电子数为NA |
 .
.