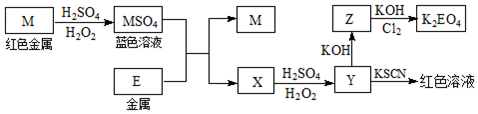
题目内容
19.有关氨的说法不正确的( )| A. | NH3是10电子微粒 | |
| B. | 氨气易液化,液氨可用作制冷剂 | |
| C. | 蘸有浓盐酸的玻璃棒遇氨气产生的白烟 | |
| D. | 氨气是电解质,NH3•H2O是非电解质 |
分析 A.根据N和H原子的电子数判断;
B.液氨挥发会吸收周围的热量;
C.氯化氢与氨气反应生成氯化铵固体;
D.氨气是非电解质,NH3•H2O是电解质.
解答 解:A.N原子含有7个电子,H原子含有1个电子,则NH3的电子数为10,故A正确;
B.氨气易液化,液氨挥发会吸收周围的热量,所以液氨可用作制冷剂,故B正确;
C.盐酸易挥发出氯化氢,氯化氢与氨气反应生成氯化铵固体,所以蘸有浓盐酸的玻璃棒遇氨气产生的白烟,故C正确;
D.氨气在熔融状态和水溶液中均不能电离,不能导电,是非电解质,NH3•H2O的溶液能导电,是电解质,故D错误.
故选D.
点评 本题考查 了氨气的性质和用途,题目难度不大,注意把握氨气的性质、电解质和非电解质的概念是解题的关键,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
10.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 等量的Zn分别与足量的稀硫酸和浓硫酸反应所得气体体积相同 | |
| C. | Li、Na、K的原子半价和熔沸点随原子序数的增加而增大 | |
| D. | P、C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
7.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
14.下列离子方程式的书写及评价,均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O | 正确,Fe2+与Fe3+物质的量之比为1:2 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应Ba2++HCO3 -+OH-═BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
4.下列离子方程式表达不正确的是( )
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 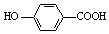 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: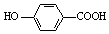 +HCO3-→ +HCO3-→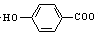 -+CO2↑+H2O -+CO2↑+H2O |
9.X、Y、W、Z为四种短周期主族元素,在周期表中的位置如图所示.W原子的最外层电子数与电子层数相同,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X只能形成一种氢化物 | |
| B. | W、X、Y的原子半径依次增大 | |
| C. | X的简单氢化物的热稳定性比Y的小 | |
| D. | W的最高价氧化物对应的水化物能溶于稀氨水 |
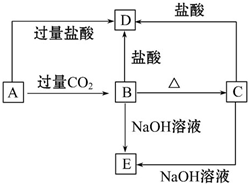 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.