题目内容
amolFeS与bmolFe3O4投入到V L cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体.所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A、
| ||
| B、(a+3b)mol | ||
C、
| ||
| D、(cV-3a-9b)mol |
考点:氧化还原反应的计算
专题:
分析:反应中硝酸起氧化剂、酸作用,未被还原的硝酸将转化为Fe(NO3)3中,由Fe元素守恒计算未被还原的硝酸的物质的量;
起氧化剂作用的硝酸生成NO,根据电子转移守恒,可以用a、b表示计算NO的物质的量,根据氮元素守恒可知,未被还原的硝酸物质的量=原硝酸总物质的量-NO的物质的量.
起氧化剂作用的硝酸生成NO,根据电子转移守恒,可以用a、b表示计算NO的物质的量,根据氮元素守恒可知,未被还原的硝酸物质的量=原硝酸总物质的量-NO的物质的量.
解答:
解:反应中硝酸起氧化剂、酸作用,起酸的作用的硝酸未被还原,
未被还原的硝酸将转化为Fe(NO3)3中,根据元素守恒可知,n[Fe(NO3)3]=n(Fe)=amol+3bmol=(a+3b)mol,所以未被还原的硝酸的物质的量=3(a+3b)mol;
起氧化剂作用的硝酸生成NO,根据电子转移守恒可知,NO的物质的量={amol×(3-2)+amol×[6-(-2)]+bmol×3×(3-
)}÷(5-2)=
mol,根据氮元素守恒,则未被还原的硝酸的物质的量=VL×cmol/L-
mol=
mol,
故选A.
未被还原的硝酸将转化为Fe(NO3)3中,根据元素守恒可知,n[Fe(NO3)3]=n(Fe)=amol+3bmol=(a+3b)mol,所以未被还原的硝酸的物质的量=3(a+3b)mol;
起氧化剂作用的硝酸生成NO,根据电子转移守恒可知,NO的物质的量={amol×(3-2)+amol×[6-(-2)]+bmol×3×(3-
| 8 |
| 3 |
| 9a+b |
| 3 |
| 9a+b |
| 3 |
| 3cV-9a-b |
| 3 |
故选A.
点评:本题以元素化合物知识为载体,考查氧化还原反应中守恒法计算技巧,为高频考点,侧重对学生思维能力的考查,题目计算量较大,答案表示不唯一,题目难度中等.

练习册系列答案
相关题目
一些装有化学物质的瓶子上贴有危险警告标签,下面是一些危险警告标签,其中贴法有错误的是( )


| A、A | B、B | C、C | D、D |
两种微粒的核外电子数相同,核电荷数不同,则它们可能是( )
| A、两种不同元素的原子 |
| B、两种所带电荷数相同的离子 |
| C、同一元素的原子和离子 |
| D、两种不同元素的原子和离子 |
下列有关说法正确的是( )
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | ||
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | ||
D、SO2(g)+2CO(g)
|
一种高聚物分子B结构如图所示

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )
A、 、HCHO和 、HCHO和 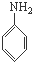 |
B、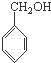 、CH3OH和 、CH3OH和 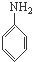 |
C、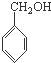 、HCHO和 、HCHO和 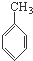 |
D、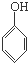 、CH3CHO和 、CH3CHO和 |