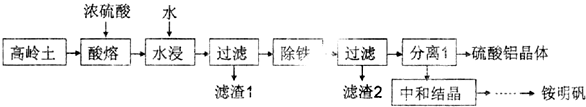
题目内容
13.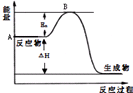 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:(1)图中A点表示反应物总能量,a=-198.
(2)Ea的大小对该反应的△H无(填“有”或“无”)影响.
(3)已知单质硫的标准燃烧热为296kJ•mol-1,写出反应的热化学方程式:S(s)+O2=SO2(g)△H=-296kJ•mol-1,常温常压下,由单质硫和氧气经两步反应,若生成4mol SO3(g),放出的总热量为1580.
分析 (1)A为反应物的总能量;1mol SO2(g)完全转化为1mol SO3(g)放热99kJ,根据参加反应SO2的物质的量之比等于对应的△H之比可计算a值;
(2)物质的活化能的大小与反应热无关;
(3)在101kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,以此书写热化学方程式;单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3的反应热利用盖斯定律来计算该题.
解答 解:(1)因图中A表示反应物总能量;因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:反应物总能量;-198;
(2)反应热为反应物总能量与生成物总能量之差,与活化能的大小无关,故答案为:无;
(3)因燃烧热概念要求必须是lmol物质完全燃烧,则热化学方程式为:S(s)+O2=SO2(g)△H=-296kJ•mol-1;因单质硫的燃烧热为296KJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296KJ•mol-1,而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,
则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296KJ•mol-1+(-99kJ•mol-1)=-395KJ•mol-1,
所以S(s)生成4molSO3(g)的热量为395KJ•mol-1×4mol=1580 KJ,
故答案为:S(s)+O2=SO2(g)△H=-296kJ•mol-1;1580.
点评 本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握盖斯定律的运用,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案乙酰苯胺的制备原理为

实验参数
| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
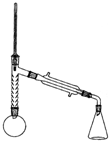
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.②苯胺易被氧化.
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105℃左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热.
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品.
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼.将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化;.
(2)从化学平衡的角度分析,控制温度计的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)通过温度计温度下降或锥形瓶内液体不再增加可判断反应基本完成、
(4)步骤1加热可用油浴(填“水浴”或“油浴”).
(5)洗涤乙酰苯胺粗品最合适的方法是A(填字母).
A.用少量冷水洗B.用少量热水洗
C.先用冷水洗,再用热水洗D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是65.7%(小数点后保留两位数字.)
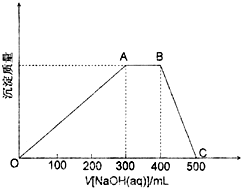
 欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为锥形瓶;
(2)盛装标准盐酸的仪器名称为酸式滴定管;
(3)滴定至终点的颜色变化为溶液由黄色变为橙色且半分钟内不褪色;
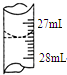
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标
准溶液的体积为26.90mL;
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1052mol/L;(保留四位有效数字)
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
PCl3(g)+Cl2(g)?PCl5(g)△H=-93.0kJ•mol-1.某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(2)该温度下,此反应的化学平衡常数的数值为$\frac{5}{6}$(可用分数表示).
(3)反应至250s 时,该反应放出的热量为37.2kJ.
(4)下列关于上述反应的说法中,正确的是abd(填字母序号).
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
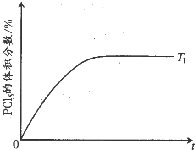
(5)温度T 1时,混合气体中PCl5的体积分数随时间t 变化的示意图如下.其他条件相同,请在下图中画出温度为T 2(T 2>T 1)时,PCl5的体积分数随时间变化的曲线.