题目内容
⑥NH4Cl溶液pH由小到大的顺序为
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3?H2O的电离常数Ka=
(2)CH3COONa的水解平衡常数Kh=
| c(CH3COOH).c(OH-) |
| c(CH3COO-) |
| c(CH3COOH).c(H+).c(OH-) |
| c(CH3COO-).c(H+) |
| Kw |
| Ka |
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,溶液中存在物料守恒和电荷守恒;
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,溶液中存在物料守恒;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等.
故答案为:①②⑥⑤④③;
(2)CH3COONa的水解平衡常数Kh=
| c(CH3COOH).c(OH-) |
| c(CH3COO-) |
| c(CH3COOH).c(H+).c(OH-) |
| c(CH3COO-).c(H+) |
| Kw |
| Ka |
| 10-14 |
| 1.7×10-5 |
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,导致混合溶液呈酸性,溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
故答案为:酸性;c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L,
故答案为:0.5mmol/L;>;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3?H2O的电离常数Ka=1.7×10-5mol/L,故答案为:1.7×10-5mol/L.

已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ;ΔH>0
CH3COO-+H+ ;ΔH>0
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是 ;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
 ④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化
的曲线是 ;
(3)25 ℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的
NaOH溶液Vb mL至溶液恰好呈中性,则Va Vb(填“>”、“<”或“=”)
假设质检部门规定市售醋酸浓度不得低于4.8g/100mL,某同学欲用中和滴定的方法来测定某品牌的食用醋中的醋酸含量是否达标。实验具体步骤如下:①托盘天平称取一定质量NaOH并配制成500mL NaOH溶液;②用已知浓度的盐酸标准溶液准确标定该NaOH溶液的浓度;③用上述已知准确浓度的NaOH溶液测定醋酸的浓度。
(4)不直接用配置的NaOH溶液滴定样品,而要用标准盐酸先标定再滴定的原因是 ;
(5)若实验过程如下:准确量取该食用醋20.00mL,置于250mL锥形瓶中,再滴加酚酞指示剂,用标定好的0.1000mol/L的NaOH溶液滴定,酚酞指示剂由 色恰好变成__________色且 即为终点。
重复滴定多次,结果记录如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(mL) | 19.40 | 15.10 | 14.90 | 15.00 |
则该食用醋中醋酸的物质的量浓度=________ mol·L-1,是否合格 (填”是”或”否”)
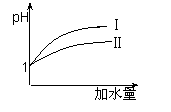 (3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水