题目内容
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
C.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C
【解析】
试题分析:氯气溶于水,部分发生反应:Cl2+H2O H++Cl-+HClO ,所以在氯水中含有Cl2、HClO、H2O、H+、Cl-、ClO-、OH-多种微粒。A.氯水的颜色呈浅黄绿色,就是由于氯水中含有Cl2,正确;B.向氯水中加入NaHCO3粉末,有气泡产生,是由于发生反应:HCO3-+OH-=H2O+ CO32-,说明氯水中含有H+,正确;C.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,是因为HClO、Cl2都有强氧化性,会把Fe2+氧化为Fe3+,不能说明氯水中是否含有HClO,错误。D.向氯水中滴加硝酸酸化的AgNO3溶液,发生反应:Cl-+Ag+=AgCl↓产生白色沉淀,说明氯水中含有Cl-,正确。
H++Cl-+HClO ,所以在氯水中含有Cl2、HClO、H2O、H+、Cl-、ClO-、OH-多种微粒。A.氯水的颜色呈浅黄绿色,就是由于氯水中含有Cl2,正确;B.向氯水中加入NaHCO3粉末,有气泡产生,是由于发生反应:HCO3-+OH-=H2O+ CO32-,说明氯水中含有H+,正确;C.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,是因为HClO、Cl2都有强氧化性,会把Fe2+氧化为Fe3+,不能说明氯水中是否含有HClO,错误。D.向氯水中滴加硝酸酸化的AgNO3溶液,发生反应:Cl-+Ag+=AgCl↓产生白色沉淀,说明氯水中含有Cl-,正确。
考点:考查新制饱和氯水成分的检验方法的知识。

(6分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。
依照该规律,请判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为 (填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4

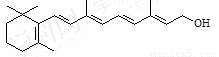 )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。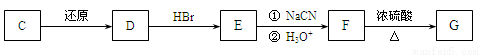


 3NH3↑+8AlO2-
3NH3↑+8AlO2-