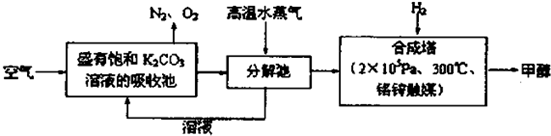
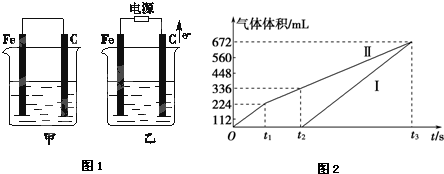
题目内容
工业上用电解法生产烧碱的主要原料是饱和食盐水,它是将粗盐溶解在水中,通过一定的分离和提纯制成的.由于粗盐中含有泥砂、CaCl2、MgCl2、Fe2(SO4)3等杂质,不符合电解的要求,因此必须进行精制.
首先将粗盐水过滤除去泥砂,再用化学试剂作进一步的净化处理.
(1)下列化学药品中可以选用的是(填写代号)
A、Ba(NO3)2B、BaCl2C、NaOH D、K2CO3
E、Na2CO3F、稀盐酸 G、硫酸
(2)所选用的化学药品要按照一定的先后顺序加入,按此顺序写出相应的离子方程式(加入的试剂都是稍过量的,可以不写满.) , , , , , .
(3)设计加入的化学试剂其先后顺序是:
在加入某种化学试剂之前,还必须增加一种物理除杂方法,这种化学试剂的名称是 ,这种物理除杂方法的名称是 .要在实验室中实施这种除杂方法,所用到的玻璃仪器有 .
(4)经过科学论证,上述净化盐水的方案合理,又通过更加精确的实验方法对净化后的盐水进行成分分析,发现其中CaCl2、MgCl2的含量还是超标,必须进一步降低其含量.对此,下列说法中正确的是
A、对盐水进行过滤
B、再从上述(1)中选取用化学试剂除杂
C、查找资料或访问专家,采用更加先进科学的方法除杂.
首先将粗盐水过滤除去泥砂,再用化学试剂作进一步的净化处理.
(1)下列化学药品中可以选用的是(填写代号)
A、Ba(NO3)2B、BaCl2C、NaOH D、K2CO3
E、Na2CO3F、稀盐酸 G、硫酸
(2)所选用的化学药品要按照一定的先后顺序加入,按此顺序写出相应的离子方程式(加入的试剂都是稍过量的,可以不写满.)
(3)设计加入的化学试剂其先后顺序是:
在加入某种化学试剂之前,还必须增加一种物理除杂方法,这种化学试剂的名称是
(4)经过科学论证,上述净化盐水的方案合理,又通过更加精确的实验方法对净化后的盐水进行成分分析,发现其中CaCl2、MgCl2的含量还是超标,必须进一步降低其含量.对此,下列说法中正确的是
A、对盐水进行过滤
B、再从上述(1)中选取用化学试剂除杂
C、查找资料或访问专家,采用更加先进科学的方法除杂.
考点:粗盐提纯
专题:实验题
分析:(1)根据盐水中含有的杂质选择试剂;
(2)除去SO42-用BaCl2,除去Mg2+、Fe3+用NaOH,碳酸钠的作用是除掉钙离子和钡离子,最后加入盐酸;
(3)分离可溶物和不溶物用过滤;根据实验步骤选择仪器;
(4)依据除杂原理分析即可.
(2)除去SO42-用BaCl2,除去Mg2+、Fe3+用NaOH,碳酸钠的作用是除掉钙离子和钡离子,最后加入盐酸;
(3)分离可溶物和不溶物用过滤;根据实验步骤选择仪器;
(4)依据除杂原理分析即可.
解答:
解:(1)已知盐水中含有Ca2+、Mg2+、Fe3+、SO42-等,除去SO42-用BaCl2,除去Mg2+、Fe3+用NaOH,除去Ca2+用Na2CO3,除去过量的Na2CO3和NaOH用HCl,故答案为:BCEF;
(2)已知盐水中含有Ca2+、Mg2+、Fe3+、SO42-等,除去SO42-用BaCl2,离子反应方程式为:SO42-+Ba2+=BaSO4↓;除去Mg2+、Fe3+用NaOH,离子反应方程式为:Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓;除去Ca2+和过量的钡离子用Na2CO3,离子反应方程式为:Ca2++CO 32-=CaCO3↓,Ba2++CO 32-=BaCO3↓;除去过量的Na2CO3和NaOH用HCl,盐酸最后加入,离子反应方程式为:2H++CO 32-=CO2↑+H2O,H++OH-=H2O;
故答案为:Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓;Ca2++CO 32-=CaCO3↓,Ba2++CO 32-=BaCO3↓;2H++CO 32-=CO2↑+H2O,H++OH-=H2O;
(3)已知盐水中含有Ca2+、Mg2+、Fe3+、SO42-等,除去SO42-用BaCl2,除去Mg2+、Fe3+用NaOH,除去Ca2+和过量的钡离子用Na2CO3,除去过量的Na2CO3和NaOH用HCl,要保证Na2CO3在氯化钡的后面,盐酸最后加入;加水溶解过滤除掉泥沙,先烧杯中加入溶解,使用烧杯和玻璃棒,再过滤,使用烧杯、漏斗、玻璃棒等,故答案为:BCEF或者CBEF或者BCEF;水;过滤;烧杯、漏斗、玻璃棒;
(4)溶液中的杂质为可溶性杂质,且含量很少,现有的除杂原理达不到除杂标准,故可以查找资料或访问专家,采用更加先进科学的方法除杂,故选C.
(2)已知盐水中含有Ca2+、Mg2+、Fe3+、SO42-等,除去SO42-用BaCl2,离子反应方程式为:SO42-+Ba2+=BaSO4↓;除去Mg2+、Fe3+用NaOH,离子反应方程式为:Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓;除去Ca2+和过量的钡离子用Na2CO3,离子反应方程式为:Ca2++CO 32-=CaCO3↓,Ba2++CO 32-=BaCO3↓;除去过量的Na2CO3和NaOH用HCl,盐酸最后加入,离子反应方程式为:2H++CO 32-=CO2↑+H2O,H++OH-=H2O;
故答案为:Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓;Ca2++CO 32-=CaCO3↓,Ba2++CO 32-=BaCO3↓;2H++CO 32-=CO2↑+H2O,H++OH-=H2O;
(3)已知盐水中含有Ca2+、Mg2+、Fe3+、SO42-等,除去SO42-用BaCl2,除去Mg2+、Fe3+用NaOH,除去Ca2+和过量的钡离子用Na2CO3,除去过量的Na2CO3和NaOH用HCl,要保证Na2CO3在氯化钡的后面,盐酸最后加入;加水溶解过滤除掉泥沙,先烧杯中加入溶解,使用烧杯和玻璃棒,再过滤,使用烧杯、漏斗、玻璃棒等,故答案为:BCEF或者CBEF或者BCEF;水;过滤;烧杯、漏斗、玻璃棒;
(4)溶液中的杂质为可溶性杂质,且含量很少,现有的除杂原理达不到除杂标准,故可以查找资料或访问专家,采用更加先进科学的方法除杂,故选C.
点评:本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )
| A、实验室中用稀盐酸与石灰石反应制取CO2 |
| B、实验室中用高锰酸钾加热分解制取O2 |
| C、实验室中用浓盐酸与二氧化锰加热制取Cl2 |
| D、实验室中用稀硫酸与锌粒反应制取H2 |
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要通过实验的验证才能决定其正确与否.下列几种类推的结论中正确的是( )
| A、已知Fe与S能直接化合得FeS,推测Cu与S化合直接化合生成CuS |
| B、已知H2O比H2S的沸点高,推测H2S比H2Se的沸点高 |
| C、已知A12S3不能在水溶液中存在,推测Mg3N2不能在水溶液中存在 |
| D、已知工业上用电解熔化的NaCl制取Na,推测用熔化的A1C13制取Al |
已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4.一般而言,该式中m 大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
| A、HClO3 |
| B、H2SeO3 |
| C、H2BO2 |
| D、HMnO4 |
称取两份等质量的铝粉,第一份加足量的浓氢氧化钠溶液,第二份加足量盐酸,充分反应放出气体(同温、同压下)体积之比为( )
| A、1:1 | B、1:3 |
| C、3:2 | D、1:4 |