题目内容
14.把一定质量的铝粉放入200mL 2mol/L的氢氧化钠溶液中,铝粉完全溶解,得到6.72LH2(标准状况下).试计算(要求:所有计算过程都必须带单位):(1)所加铝粉的质量.
(2)反应后溶液中NaOH的物质的量浓度(溶液体积变化忽略不计).
分析 发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合电子守恒及反应计算.
解答 解:(1)n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,由电子守恒可知,n(Al)=$\frac{0.3mol×2×(1-0)}{(3-0)}$=0.2mol,其质量为0.2mol×27g/mol=5.4g,
答:所加铝粉的质量为5.4g;
(2)由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,生成氢气0.3mol,消耗NaOH为0.2mol,则反应后溶液中NaOH的物质的量浓度为$\frac{0.2L×2mol/L-0.2mol}{0.2L}$=1mol/L,
答:反应后溶液中NaOH的物质的量浓度为1mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、电子守恒为解答的关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
19.K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O?4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示.下列说法不正确的是:( )
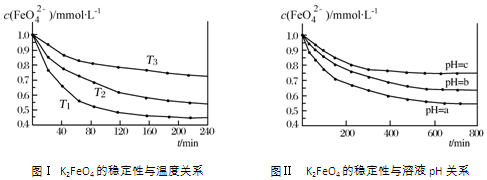

| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
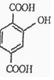
5.下列关于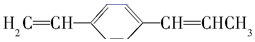 的说法正确的是( )
的说法正确的是( )
 的说法正确的是( )
的说法正确的是( )| A. | 所有原子都在同一平面上 | |
| B. | 最多有4个碳原子在同一直线上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 最多只能有9个碳原子在同一平面上 |
6.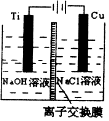 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是反应不易控制,易还原产生Cu.
(2)己知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(s)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c-a-bkJ•mol-1.
(3)方法II采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
下列叙述正确的是AC(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10-5mol/(L•min)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=1.8×10-7mol/L.(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.001mol/L盐酸,是否继续产生沉淀否(填“是”或“否”).
 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)己知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(s)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c-a-bkJ•mol-1.
(3)方法II采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10-5mol/(L•min)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=1.8×10-7mol/L.(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.001mol/L盐酸,是否继续产生沉淀否(填“是”或“否”).
4.大庆市某中学化学实验小组在实验室鉴定某无色溶液.已知溶液中的溶质仅由NH4+、K+、Ag+、Ca2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成.取该溶液进行如下实验:
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时产生白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时产生白色沉淀乙
则下列离子在原溶液中一定存在的有( )
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时产生白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时产生白色沉淀乙
则下列离子在原溶液中一定存在的有( )
| A. | K+、CO32、AlO2- | B. | SO42-、AlO2-、K+、CO32-、 | ||
| C. | CO32-、K+、Al3+ | D. | MnO4-、K+、CO32-、NH4+ |
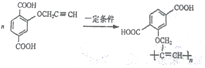
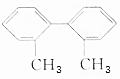 ,请完成下列空白:
,请完成下列空白: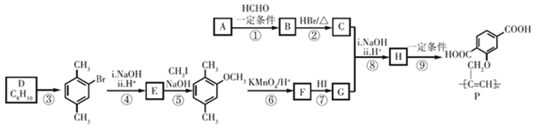
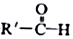 $\stackrel{一定条件}{→}$R-C≡
$\stackrel{一定条件}{→}$R-C≡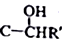
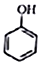 +CH2I$\stackrel{NaOH}{→}$
+CH2I$\stackrel{NaOH}{→}$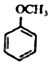 +NaI+H2O
+NaI+H2O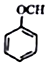 +HI→
+HI→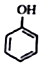 +CH2I
+CH2I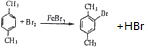 .
. .
. .
.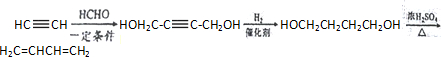 .
.