题目内容
在一个体积为2L的容器中,充入4mol CO和4mol H2O,一段时间后反应CO(g) + H2O(g)  CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为
CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为
 CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为
CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为[ ]
A.27
B.36
C.54
D.81
B.36
C.54
D.81
C

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
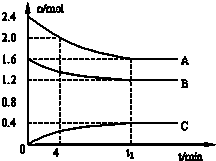
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示. C
C