题目内容
在KClO3+5KCl+3H2SO4═3K2SO4+3Cl2↑+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )
| A、1:1 | B、5:1 |
| C、1:5 | D、3:1 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素的化合价升高,被氧化;KClO3中Cl元素的化合价降低,被还原.
解答:
解:由5K
+K
O3+3H2SO4═3
2↑+3K2SO4+3H2O可知,
KCl中Cl元素的化合价升高,被氧化,而KClO3中Cl元素的化合价降低,被还原,
由方程式可知,n(KCl):n(KClO3)=5:1,
被氧化与被还原的都是Cl,其物质的量之比等于质量之比,
则被氧化的氯元素与被还原的氯元素的质量比为5:1,
故选B.
| -1 |
| Cl |
| +5 |
| Cl |
| 0 |
| Cl |
KCl中Cl元素的化合价升高,被氧化,而KClO3中Cl元素的化合价降低,被还原,
由方程式可知,n(KCl):n(KClO3)=5:1,
被氧化与被还原的都是Cl,其物质的量之比等于质量之比,
则被氧化的氯元素与被还原的氯元素的质量比为5:1,
故选B.
点评:本题考查氧化还原反应,熟悉元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的基本概念来解答即可,难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
“化学是实验的科学,只有实验才是检验理论的标准”.下列关于各实验装置图的叙述中,正确的是( )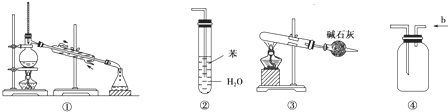

| A、装置①是用于分离互不相溶的液体混合物 |
| B、装置②可用于吸收NH3并防止倒吸 |
| C、以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D、装置④中b进气可收集Cl2、NO等气体 |
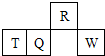 短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是( )
短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是( )| A、原子半径的大小:W>Q>R |
| B、气态氢化物的稳定性:R>Q>T |
| C、对应含氧酸的酸性强弱:W>Q>T |
| D、R分别与T、Q、W形成化合物的晶体均为分子晶体 |
下列有关环境问题的说法中,不正确的是( )
| A、形成酸雨的主要原因是雨水中溶有CO2 |
| B、氟氯代烷和氮氧化物等会破坏臭氧层 |
| C、CO2、CH4等是造成温室效应的气体 |
| D、白色污染是指废弃塑料制品造成的污染 |
工业制硫酸的第一步反应,可用化学方程式表示如下:4FeS2+11O2=2Fe2O3+8SO2对此反应下列说法中正确的是( )
| A、FeS2既是氧化剂又是还原剂 |
| B、O2只做氧化剂 |
| C、氧化产物只有Fe2O3 |
| D、4mol FeS2发生反应时,反应中共有22mol电子转移 |
查处酒后驾驶所采用的“便携式乙醇测量仪”以燃料电池为工作原理;在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际上乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+.下列说法正确的是( )
| A、另一电极反应式为:O2+4e-+2H2O=4OH- |
| B、检测时,溶液中的H+向负极移动 |
| C、乙醇在正极发生反应,电子经过外电路流向负极 |
| D、电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列关于阿佛加德罗常数的说法正确的是( )
| A、1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
| B、一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA |
| C、常温下18g铝放入足量浓硫酸中转移电子数2NA |
| D、0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 |