题目内容
某同学设计的制取氯气和验证氯气部分化学性质的实验装置如图所示:
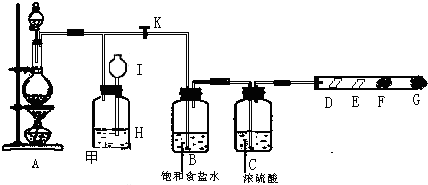
其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸,F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球.回答下列问题:
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的化学方程式:______;
(2)B处饱和食盐水是为了除去______.
(3)在E处,紫色石蕊纸的颜色由紫色变为红色,再变为无色,其原因是______.
(4)当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体.则甲装置的作用为______.
(5)G处可能发生反应的化学方程式______.
解:(1)浓盐酸具有还原性,二氧化锰有氧化性,在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以制取的氯气中有氯化氢气体,氯化氢极易溶于水,氯气也能溶于水,饱和食盐水中有氯离子,抑制氯气的溶解,且吸收氯化氢气体,
故答案为:氯气中混有氯化氢气体;
(3)紫色石蕊遇酸变红色,次氯酸有漂白作用,氯气和水反应生成盐酸和次氯酸,所以在E处,紫色石蕊纸的颜色由紫色变为红色,再变为无色,
故答案为:生成的氯化氢使紫色的石蕊试液变红色,剩余的氯气和水反应生成次氯酸,次氯酸起漂白作用,使红色褪去;
(4)关闭活塞K,生成的氯气进入甲装置,导致H瓶中的压强大于大气压,为平衡压强,导致I瓶中液面上升,H瓶中充满黄绿色气体.所以甲装置的作用是储存多余的氯气,
故答案为:储存多余的氯气;
(5)氯气和水反应生成盐酸和次氯酸,酸能和碱反应生成盐和水,所以氯气能和碱反应,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
分析:(1)根据浓盐酸、二氧化锰的性质及反应条件写出相应的化学反应方程式;
(2)根据浓盐酸的性质判断氯气中混有杂质的性质分析;
(3)紫色石蕊遇酸变红色,次氯酸有漂白作用,根据盐酸和次氯酸的性质分析;
(4)根据装置特点分析;
(5)根据氯气的性质分析.
点评:本题考查了氯气的实验室制法及化学性质等知识点,难度不大,次氯酸的漂白性是重要考点.
 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,故答案为:4HCl(浓)+MnO2
 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;(2)浓盐酸具有挥发性,所以制取的氯气中有氯化氢气体,氯化氢极易溶于水,氯气也能溶于水,饱和食盐水中有氯离子,抑制氯气的溶解,且吸收氯化氢气体,
故答案为:氯气中混有氯化氢气体;
(3)紫色石蕊遇酸变红色,次氯酸有漂白作用,氯气和水反应生成盐酸和次氯酸,所以在E处,紫色石蕊纸的颜色由紫色变为红色,再变为无色,
故答案为:生成的氯化氢使紫色的石蕊试液变红色,剩余的氯气和水反应生成次氯酸,次氯酸起漂白作用,使红色褪去;
(4)关闭活塞K,生成的氯气进入甲装置,导致H瓶中的压强大于大气压,为平衡压强,导致I瓶中液面上升,H瓶中充满黄绿色气体.所以甲装置的作用是储存多余的氯气,
故答案为:储存多余的氯气;
(5)氯气和水反应生成盐酸和次氯酸,酸能和碱反应生成盐和水,所以氯气能和碱反应,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
分析:(1)根据浓盐酸、二氧化锰的性质及反应条件写出相应的化学反应方程式;
(2)根据浓盐酸的性质判断氯气中混有杂质的性质分析;
(3)紫色石蕊遇酸变红色,次氯酸有漂白作用,根据盐酸和次氯酸的性质分析;
(4)根据装置特点分析;
(5)根据氯气的性质分析.
点评:本题考查了氯气的实验室制法及化学性质等知识点,难度不大,次氯酸的漂白性是重要考点.

练习册系列答案
相关题目



