题目内容
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用甲烷氧化法合成甲醇的反应有:
(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ?mol-1
(Ⅱ)2CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ?mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ?mol-1
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 .
(2)某温度下,向4L恒容密闭容器中通人6mol C02和6mol CH4,发生反应(Ⅰ),平衡体系中各组分的体积分数均为
,则此温度下该反应的平衡常数K= ,CH4的转化率为 .
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)?HCOOCH3(g)△H2=-29.1kJ?mol-1.科研人员对该反应进行了研究,部分研究结果如图1、2:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106PaPa““4.0×106Pa“或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是 .
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC的工作原理如图3所示:
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为
②常温下,用此电池以惰性电极电解O.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化).
(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ?mol-1
(Ⅱ)2CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ?mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ?mol-1
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为
(2)某温度下,向4L恒容密闭容器中通人6mol C02和6mol CH4,发生反应(Ⅰ),平衡体系中各组分的体积分数均为
| 1 |
| 4 |
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)?HCOOCH3(g)△H2=-29.1kJ?mol-1.科研人员对该反应进行了研究,部分研究结果如图1、2:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC的工作原理如图3所示:
①通入a气体的电极是电池的
②常温下,用此电池以惰性电极电解O.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH为
考点:用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)根据盖斯定律计算书写热化学方程式;
(2)根据平衡体系中各组分的体积分数均为
,利用三段式计算出平衡时各组分的含量,计算平衡常数和转化率;
(3)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
②根据电解池的工作原理和电极方程式来计算.
(2)根据平衡体系中各组分的体积分数均为
| 1 |
| 4 |
(3)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
②根据电解池的工作原理和电极方程式来计算.
解答:
解:(1)根据(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ?mol-1
(Ⅱ)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ?mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ?mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ?mol-1)×2+(-90.1kJ?mol-1)×2+(-566.0kJ?mol-1)=-251.6kJ?mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ?mol-1,
故答案为:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ?mol-1;
(2)CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始(mol) 6 6 0 0
变化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡体系中各组分的体积分数均为
,所以6-x=2x,解得x=2,
则此温度下该反应的平衡常数X=
=
=1,
CH4的转化率为
=33.3%,
故答案为:1;33.3%;
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是4.0×106Pa,故答案为:4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
②用此电池以惰性电极电解饱和食盐水的电极反应为:2Cl-+2H2O
H2↑+Cl2↑+2OH-,当两极共收集到标准状况下的气体1.12L(0.05mol)时,则生成氢氧化钠的物质的量是0.05mol,所以COH-=
=0.1mol/L,所以PH=13,故答案为:13.
(Ⅱ)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ?mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ?mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ?mol-1)×2+(-90.1kJ?mol-1)×2+(-566.0kJ?mol-1)=-251.6kJ?mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ?mol-1,
故答案为:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ?mol-1;
(2)CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始(mol) 6 6 0 0
变化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡体系中各组分的体积分数均为
| 1 |
| 4 |
则此温度下该反应的平衡常数X=
| c 2(CO)?c 2(H 2) |
| c(CH 4)?c(CO 2) |
| 1 2×1 2 |
| 1×1 |
CH4的转化率为
| 2 |
| 6 |
故答案为:1;33.3%;
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是4.0×106Pa,故答案为:4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低;
(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
②用此电池以惰性电极电解饱和食盐水的电极反应为:2Cl-+2H2O
| ||
| 0.05mol |
| 0.5L |
点评:本题考查了盖斯定律的应用、热化学方程式的计算书写、化学平衡的计算、图象分析判断以及电化学的知识等,注意掌握基础知识的掌握,题目难度中等.

练习册系列答案
相关题目
据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH?CH3CHO;已知△H<0.据此你认为下列说法中错误的是( )
| A、该星球表面温度很高 |
| B、该星球表面温度很低 |
| C、该反应为放热反应 |
| D、高温下稳定性CH2=CHOH>CH3CHO |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-) |
| C、常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol?L-1 |
| D、物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
下列氧化物的稳定性前者比后者强的是( )
| A、CO和CO2 |
| B、GeO和GeO2 |
| C、SnO和SnO 2 |
| D、PbO和PbO2 |
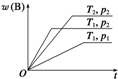 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |
与氢气完全加成后,能生成2-甲基丁烷的烃是( )
| A、CH2=CH-CH2-CH3 |
| B、CH2=C(CH3) CH=CH2 |
| C、(CH3)2CHCH=CH2 |
| D、(CH3)3CCH═CH2 |