题目内容
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
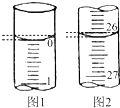
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | ① | ② |
| 第二次 | 25.00 | 1.56 | 27.68 | 26.12 |
| 第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=
考点:中和滴定
专题:实验题
分析:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
(2)根据c(待测)=
分析不当操作对V(标准)×的影响,以此判断浓度的误差;
(3)依据图示读取滴定前后刻度值;
(4)根据盐酸和NaOH反应求出C(NaOH先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH).
(2)根据c(待测)=
| c(标准)×c(标准) |
| V(待测) |
(3)依据图示读取滴定前后刻度值;
(4)根据盐酸和NaOH反应求出C(NaOH先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH).
解答:
解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;
(2)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
可知,测定c(NaOH)偏大,故A不符合;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
可知,测定c(NaOH)无影响,故B不符合;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
可知,测定c(NaOH)偏大,故C不符合;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
可知,测定c(NaOH)偏低,故D符合;
故答案为:D;
(3)起始读数为0.00mL,终点读数为26.10mL,
故答案为:26.10;
(4)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.09mL,
HCl+NaOH=NaCl+H2O
0.02609L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=
=0.1044mol/L;
故答案为:0.1044mol/L.
故答案为:锥形瓶中溶液颜色的变化;
(2)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
| c(标准)×c(标准) |
| V(待测) |
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
| c(标准)×c(标准) |
| V(待测) |
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
| c(标准)×c(标准) |
| V(待测) |
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
| c(标准)×c(标准) |
| V(待测) |
故答案为:D;
(3)起始读数为0.00mL,终点读数为26.10mL,
故答案为:26.10;
(4)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.09mL,
HCl+NaOH=NaCl+H2O
0.02609L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=
| 0.02609L×0.1000mol/L |
| 0.025L |
故答案为:0.1044mol/L.
点评:本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与阴阳离子半径比关系如图所示),经测定其密度为ρg?cm-3,其摩尔质量为Mg?mol-1,则下列有关该晶体的说法正确的是( )
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
| A、该晶体结构与ZnS晶体相似 | |||||
| B、该晶体每个晶胞中有2个A2+和B2- | |||||
C、该晶体晶胞的边长
| |||||
| D、A2+离子紧邻的B2-构成的空间结构为正方体 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+ |
| C、向反应后的溶液加入乙醇,溶液将会没有发生任何变化,因[Cu(NH3)4]2+不会与乙醇发生反应 |
| D、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
有两气态脂肪烃的混合气体,它们都能使溴水褪色,且分子中碳原子数均小于5.1体积该混合气体完全燃烧后,可得3.6体积的CO2和3体积的水蒸气(体积在同温同压下测定),这两种烃的分子式及体积比为( )
| A、C2H4与C4H8,体比为17:53 |
| B、C2H2与C4H8,体积比为17:58 |
| C、C3H6与C4H6,体积比为2:3 |
| D、C2H4与C4H8,体积比为17:23 |
关于乙醇结构与性质的说法中正确的是( )
| A、乙醇结构中有-OH,其水溶液可以电离出OH-而显碱性 |
| B、乙醇与乙酸在一定条件下反应生成乙酸乙酯 |
| C、乙醇与钠反应可以产生氢气,所以乙醇显酸性 |
| D、乙醇与钠反应比较平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 |
 甲酸(CH2O2),俗称蚁酸,结构式为:
甲酸(CH2O2),俗称蚁酸,结构式为: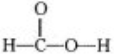 .某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
.某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.