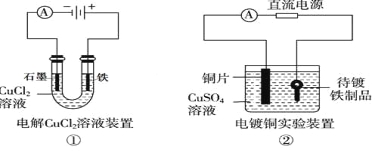
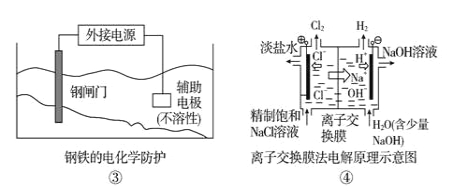
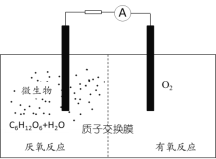
题目内容
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g) ![]() 2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,平衡右移的是
2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,平衡右移的是
A. 均增加1mol B. 均减小1mol C. 均减半 D. 均加倍
【答案】A
【解析】在恒温恒压条件下,如果投料配比与原平衡相同,则可建立等效平衡。C中均减半与D中均加倍都没有改变原平衡混合物的比例,所以平衡不发生移动。A中均增加1mol。可以分两次加入,先按原比例把1molA、0.5molB、1molC加入体系中,平衡不发生移动,此时再加入余下的0.5molB,增大了反应物的浓度,化学平衡向正反应方向移动,所以A正确。B,同理分析,与A相反,平衡向左移动,B不正确。

【题目】A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________
A.配位键 B.极性共价键 C.非极性共价键 D.离子键