题目内容
【题目】某化学兴趣小组欲设计使用如下装置探究:铜和一定量的浓硝酸反应是否有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,不考虑浓硝酸的挥发,且忽略反应中的溶液体积变化)

试回答下列问题:
(1)铜粉的作用是___________________;将铜粉分散在是石棉绒中的原因_____________。
(2)在铜和浓硝酸反应前,关闭k3,打开k1、k2 ,挤压打气球,经A、B、C反应后,进入D中的气体是_____(填化学式)。
(3)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:____________;
(4)E装置中发生反应的化学方程式为_____________________________。
(5)从E装置所得溶液中取出25.00mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL,则E中所得硝酸的物质的量浓度为_________mol/L,若实验测得F装置所收集到的气体体积为139.00 mL,则气体的成分为_________(填化学式),则铜和一定量的浓硝酸反应有______ mL NO生成。
【答案】 除去空气中的氧气,防止干扰实验 增大铜粉与氧的接触面积使反应充分 N2 Cu+2NO- 3+4H+=Cu2++2NO2↑+2H2O 3NO2+H2O=2HNO3+NO 0.0720 N2 和NO 8.36
【解析】(1)铜粉的作用是除去空气中的氧气,防止干扰实验;将铜粉分散在是石棉绒中的原因增大铜粉与氧的接触面积使反应充分;(2)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气,所以进入D装置的气体主要是N2;(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜、二氧化氮和水,可能发生的反应是浓硝酸变稀后和铜的反应生成硝酸铜、一氧化氮和水;因此D中一定发生反应的离子方程式:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;(4)E装置中二氧化氮与水反应生成硝酸和一氧化氮,发生反应的化学方程式为3NO2+H2O=2HNO3+NO;(5)从E装置所得溶液中取出25.00mL,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则设硝酸浓度为C,发生的反应实质是H++OH-=H2O,所以25.00mL×C=18.00mL×0.1000mol/L,解得C=0.0720mol/L; E装置中生成的硝酸溶液体积为100mL,浓度为0.0720mol/L,所以生成硝酸物质的量为0.0072mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0036mol,在标准状况下的体积=0.0036mol×22.4L/mol=0.08064L=80.64ml,而试管中原有50 mL N2,二者之和为80.64 mL+ 50 mL=130.64 mL。而测得F装置所收集到的气体体积为139.00 mL,说明生成NO2的同时有NO生成,且生成的NO体积为139.00mL – 130.64 mL=8.36 mL。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是( )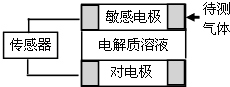
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2+2e﹣═2Cl﹣
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同

