题目内容
18.现有 0.4mol/L HA溶液和0.2mol/L NaOH溶液等体积混合组成的混合溶液.下列有关推断不正确的是( )| A. | 若HA 的电离能力大于A-的水解能力,则有c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
| B. | 若A-的水解能力大于HA 的电离能力,则有c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+) | |
| C. | 无论该溶液呈酸性还是碱性,都有 c(Na+)+c(H+)=c(A-)+c(OH-) | |
| D. | 无论该溶液呈酸性还是碱性,都有2c(Na+)=c(A-)+c(HA) |
分析 将0.4mol•L-1HA溶液和0.2mol•L-1的NaOH溶液等体积混合后,溶液溶质为HA和NaA,二者浓度相等,一般溶液显酸性,酸的电离为主,也可能为中性或碱性,取决电离与水解的程度,以此解答该题.
解答 解:将0.4mol•L-1HA溶液和0.2mol•L-1的NaOH溶液等体积混合后,溶液溶质为HA和NaA,二者浓度相等,
A.若该溶液中HA电离能力大于A-水解能力,溶液显酸性,则有c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故A正确;
B.若该溶液中A-水解能力大于HA电离能力,溶液显碱性,则有c(HA)>(Na+)>c(A-)>c(OH-)>c(H+),故B错误;
C.无论该溶液呈酸性还是碱性,溶液遵循电荷守恒,都有c(Na+)+c(H+)=c(A-)+c(OH-),故C正确;
D.无论该溶液呈酸性还是碱性,由物料守恒可知都有2c(Na+)=c(A-)+c(HA),故D正确;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,反应后溶质的量及电离、水解的大小,结合电荷守恒和物料守恒解答.

练习册系列答案
相关题目
9.下列说法不正确的是( )
| A. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| B. | 在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 聚合物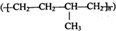 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
6.一江清水送北京是十堰人民对首都人民的承诺,水质问题很重要,十堰某地有两个工厂的污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-.两厂单独处理成本很高,如果将两厂的污水按一定比例混合,过滤沉淀后污水就变为无色澄清且只含NaNO3,污染程度大大降低.关于污染源的分析,你认为正确的是( )
| A. | Cl- 和NO3-一定来自不同的工厂 | B. | SO42- 和NO3-可能来自同一工厂 | ||
| C. | Ag+ 和Na+ 可能来自同一工厂 | D. | Na+ 和NO3-一定来自同一工厂 |
3.某学生的实验报告所列出的下列数据中正确的是( )
| A. | 用托盘天平称取15.80g NaCl固体 | |
| B. | 用10mL量筒量取6.25 mL稀硝酸 | |
| C. | 用精密pH试纸测得某溶液的pH为4.2 | |
| D. | 做中和滴定实验时,用50mL规格的酸式滴定管去取17.90mL的烧碱溶液 |
20.在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、Fe2+、H+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
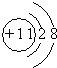 ;
; ,E离子的符号为Cl-;
,E离子的符号为Cl-;