题目内容
关于下列图示的说法中正确的是( )

分析:A、反应物的能量高于生成物,反应是放热反应;
B、电解硫酸铜溶液阳极氢氧根离子失电子生成氧气,阴极上铜离子得到电子生成铜单质,依据电子守恒分析;
C、装置中是原电池,左图中铝做负极失电子生成铝离子,右图是铁做负极失电子生成亚铁离子,依据电子守恒计算分析判断;
D、分液漏斗中加入盐酸和锥形瓶中的碳酸钙反应生成二氧化碳气体,通过试管中的硅酸钠溶液会出现沉淀证明碳酸酸性大于硅酸.
B、电解硫酸铜溶液阳极氢氧根离子失电子生成氧气,阴极上铜离子得到电子生成铜单质,依据电子守恒分析;
C、装置中是原电池,左图中铝做负极失电子生成铝离子,右图是铁做负极失电子生成亚铁离子,依据电子守恒计算分析判断;
D、分液漏斗中加入盐酸和锥形瓶中的碳酸钙反应生成二氧化碳气体,通过试管中的硅酸钠溶液会出现沉淀证明碳酸酸性大于硅酸.
解答:解:A、图象分析反应物的能量高于生成物,反应是放热反应,△H<0,故A错误;
B、电解硫酸铜溶液阳极氢氧根离子失电子生成氧气,电极反应4OH--4e-=2H2O+O2↑,阴极上铜离子得到电子生成铜单质,Cu2++2e-=Cu,依据电子守恒分析,阳极和阴极两电极产生单质的物质的量之比为1:2,故B错误;
C、装置中是原电池,左图中铝做负极失电子生成铝离子,电极反应Al-3e-=Al3+,右图是铁做负极失电子生成亚铁离子,Fe-2e-=Fe2+,由电子守恒计算可知消耗电极材料物质的量为2molAl,3molFe,故C错误;
D、分液漏斗中加入盐酸和锥形瓶中的碳酸钙反应生成二氧化碳气体,通过试管中的硅酸钠溶液会出现沉淀证明碳酸酸性大于硅酸,CO2+SiO32-+H2O=H2SiO3↓+CO32-,故D正确;
故选D.
B、电解硫酸铜溶液阳极氢氧根离子失电子生成氧气,电极反应4OH--4e-=2H2O+O2↑,阴极上铜离子得到电子生成铜单质,Cu2++2e-=Cu,依据电子守恒分析,阳极和阴极两电极产生单质的物质的量之比为1:2,故B错误;
C、装置中是原电池,左图中铝做负极失电子生成铝离子,电极反应Al-3e-=Al3+,右图是铁做负极失电子生成亚铁离子,Fe-2e-=Fe2+,由电子守恒计算可知消耗电极材料物质的量为2molAl,3molFe,故C错误;
D、分液漏斗中加入盐酸和锥形瓶中的碳酸钙反应生成二氧化碳气体,通过试管中的硅酸钠溶液会出现沉淀证明碳酸酸性大于硅酸,CO2+SiO32-+H2O=H2SiO3↓+CO32-,故D正确;
故选D.
点评:本题考查了物质能量高低与物质活泼性的比较,原电池和电解原理的应用,酸性强的可以制备酸性弱的物质,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
关于下列图示的说法中正确的是( )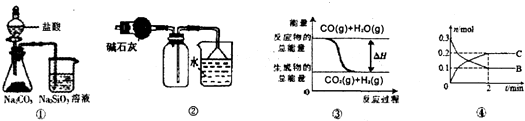

| A、由图①所示实验可得出三种元素的非金属性强弱顺序是:氯>碳>硅 | B、图②可用于干燥、收集氯化氢,并吸收多余的氯化氢 | C、图③表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | D、对反应:A(s)+2B(g)?xC(g),根据图④可以求出x=2 |
关于下列图示的说法中,正确的是( )
A、 如图表示可逆反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0 | B、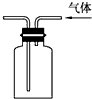 如图所示实验装置排空气法收集CO2气体 | C、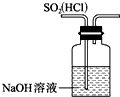 如图装置可以用来除去SO2中的HCl | D、 如图所示实验可比较硫、碳、硅三种元素的非金属性强弱 |


