题目内容
4.标准状况下,将二氧化氮和氧气按4:1的体积比混合后,充满一烧瓶,倒扣于水槽中,发生反应的方程式可看作:4NO2+O2+2H2O=4HNO3,当反应不再进行时,假设溶液没有损失,则所得溶液的物质的量浓度为:$\frac{1}{28}$mol/L.分析 设出二氧化氮和氧气的体积,NO2和O2按体积比4:1混合后充入一干燥烧瓶中,把烧瓶倒置于水中发生反应:4NO2+O2+2H2O=4HNO3,根据方程式计算.
解答 解:设混合气体中含有标准状况下4VLNO2,1VLO2,则烧瓶的体积为5VL,反应后烧瓶中会充满溶液,则溶液体积为5V,
4NO2 +O2 +2H2O=4HNO3
$\frac{4V}{22.4}$mol $\frac{4V}{22.4}$mol
c(HNO3)=$\frac{\frac{4V}{22.4}}{5V}$mol/L=$\frac{1}{28}$mol/L;故答案为:$\frac{1}{28}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确发生反应实质及物质的量浓度的表达式为解答关键,注意熟练掌握物质的量与标准状况下的气体摩尔体积之间的转化关系.

练习册系列答案
相关题目
14.下列反应在一定条件下,能达到化学平衡状态的是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2SO2+O2$?_{△}^{催化剂}$2SO3 | ||
| C. | NaOH+HNO3═NaNO3+H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
15.不能达到除杂目的是(括号内物质为少量杂质)( )
| A. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 |
12.以下为三种有机物的有关信息,根据表中信息回答问题.
(1)A结构简式是CH2=CH2.该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色.其中,与高锰酸钾溶发生的反应是氧化反应(填反应类型);与溴反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为18.8g.
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为 .
.
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为CH4+2Cl2$\stackrel{光照}{→}$CH2Cl2+2HCl.
| A | B | C |
| 其产量用来衡量一个国家的石油化工水平. | 比例模型为: | 沼气主要成分 |
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为
 .
.(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为CH4+2Cl2$\stackrel{光照}{→}$CH2Cl2+2HCl.
19.下列对于浓硝酸、浓硫酸的说法,不正确的是( )
| A. | 浓硝酸在见光或受热时会发生分解 | |
| B. | 金属与硝酸反应不产生氢气 | |
| C. | 可用铁和铝制品盛装浓硝酸、浓硫酸 | |
| D. | 往浓硫酸与铜反应后的试管中加水稀释,溶液呈蓝色,说明生成了Cu2+ |
9.如图为铜锌原电池示意图,下列说法正确的是( )
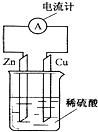

| A. | 锌片逐渐溶解 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
1.X、Y、Z均为元素周期表中的前20号元素,可形成化合物XYZ4,三种元素的最外层电子数之和为14,且均不在同一周期和同一主族.下列有关推断不正确的是( )
| A. | 若X 化合价为+2价,则Y的化合价为+6价 | |
| B. | 若XYZ4是一种可溶性的盐,则XY也是一种可溶性的盐 | |
| C. | 若XYZ4是一种强酸,则XY 也是一种强酸 | |
| D. | XYZ4可能是共价化合物,也可能是离子化合物 |
18.下列各组物质中,互为同分异构体的是( )
| A. | ${\;}_{3}^{6}$Li和${\;}_{3}^{7}$Li | B. | CH3-CH2-CH2-CH3和CH3-CH(CH3)-CH3 | ||
| C. | O2和O3 | D. | CH4和CH3-CH3 |
19.下列离子方程式中不正确的是( )
| A. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 酸性高锰酸钾溶液中加入草酸:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| C. | 硫代硫酸钠溶液中加入稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 将氧气通入酸性碘化钾溶液中:2I-+O2+4H+═I2+2H2O |