题目内容
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(1)ClO2的制备方法比较实用的有数十种,下列方法是常见方法之一.
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
方法三:实验室常用氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯
①方法一:当有0.4mol电子发生转移时,得到的还原产物为 mol.
②方法二:该反应中H2O2 (填序号).
a.发生氧化反应 b.仅做氧化剂
c.既被氧化又被还原 d.既未被氧化也未被还原
③方法三的化学反应方程式为: .
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物.写出该反应的化学方程式: .
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的 倍.
(4)ClO2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2氧化除去CN-的离子方程式 .某工厂污水中含CN- a mg/L,处理100m3这种污水,至少需要ClO2 mol.
(1)ClO2的制备方法比较实用的有数十种,下列方法是常见方法之一.
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
方法三:实验室常用氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯
①方法一:当有0.4mol电子发生转移时,得到的还原产物为
②方法二:该反应中H2O2
a.发生氧化反应 b.仅做氧化剂
c.既被氧化又被还原 d.既未被氧化也未被还原
③方法三的化学反应方程式为:
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物.写出该反应的化学方程式:
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的
(4)ClO2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2氧化除去CN-的离子方程式
考点:氧化还原反应,氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5价降低为+4价,被还原,有2mol电子转移生产2mol还原产物ClO2;
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水;
(3)由化合价变化计算转移等电子时的物质的量;
(4)ClO2氧化除去CN-,生成氮气、二氧化碳和氯离子;结合氧化还原反应方程式计算.
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水;
(3)由化合价变化计算转移等电子时的物质的量;
(4)ClO2氧化除去CN-,生成氮气、二氧化碳和氯离子;结合氧化还原反应方程式计算.
解答:
解:(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5价降低为+4价,被还原,有2mol电子转移生产2mol还原产物ClO2,则当有0.4mol电子发生转移时,得到的还原产物为0.4mol,故答案为:0.4;
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高,作还原剂,发生氧化反应,故答案为:a;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水,反应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水,反应为24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O,
故答案为:24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O;
(3)处理含CN-相同量的电镀废水,转移电子相同,所需Cl2的物质的量是ClO2的
=2.5倍,故答案为:2.5;
(4)ClO2氧化除去CN-的离子方程式为2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
含CN-a mg/L,处理100m3这种污水,n(CN-)=
=
mol,由2ClO2+2CN-=2CO2↑+N2↑+2Cl-可知,至少需要ClO2
mol,
故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
.
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高,作还原剂,发生氧化反应,故答案为:a;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水,反应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水,反应为24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O,
故答案为:24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O;
(3)处理含CN-相同量的电镀废水,转移电子相同,所需Cl2的物质的量是ClO2的
| 4-(-1) |
| 2×[0-(-1)] |
(4)ClO2氧化除去CN-的离子方程式为2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
含CN-a mg/L,处理100m3这种污水,n(CN-)=
| 100×103L×a×10-3g |
| 26g/mol |
| 50a |
| 13 |
| 50a |
| 13 |
故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
| 50a |
| 13 |
点评:本题考查氧化还原反应及计算,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、分析能力和计算能力的考查,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
碳纳米管为单、双键交替共轭结构,电子传输效果很好,可用作导电材料.现有1根由180个碳原子构成的碳纳米管,若要将这根C180的碳纳米管完全氢化形成C180H180,则放出的热量约为(已知1mol碳碳双键氢化时约放热120kJ)( )
| A、1.79×10-20 kJ |
| B、3.59×10-20 kJ |
| C、1.08×104kJ |
| D、2.16×104kJ |
某溶液用石蕊试液试验显红色,用甲基橙试液显黄色,则该溶液的pH值( )
| A、PH<5 |
| B、4.4<PH<5 |
| C、PH>8 |
| D、3.1<PH<4.4 |
a mol N2与a mol CO相比较,下列叙述中不正确的是( )
| A、质量一定相同 |
| B、所含分子数一定相同 |
| C、所含原子数一定相同 |
| D、气体体积一定相同 |
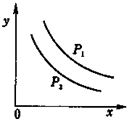 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是

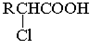 ;RCH2Br
;RCH2Br