题目内容
下列溶液中离子浓度的关系一定正确的是
A.. 和
和 溶液中:
溶液中:
B..一元弱碱MOH对应的盐MCl溶液中:
C..等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
D.. pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
C
【解析】
试题分析:A、电荷守恒式中c(CO32-)应乘以2;B、一元弱碱MOH对应的盐MCl溶液水解显酸性,但水解是微弱的,离子浓度应为c(Cl-)>c(M+)>c(H+)>c(OH-);C、正确;D、未说明酸、碱是否为强酸或强碱,则等体积混合后溶液不一定为中性。
考点:考查溶液中离子浓度关系。

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
②A与D形成的化合物常温下为液态; |
③B元素原子价电子(外围电子)排布为nSnnPn |
④F元素原子的核外p电子总数比s电子总数多1; |
⑤第一电子能:F<E; |
⑥G的基态原子核外有6个未成对电子; |
⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2) 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5) 极易溶于
极易溶于 ,原因是 。
,原因是 。
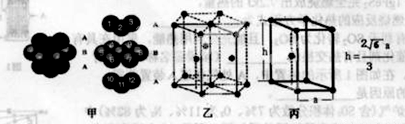
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
若已知E原子半径为r pm, 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和 代数式表示)
代数式表示)
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| 已知 | 类推 |
A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |





