题目内容
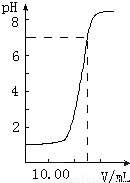
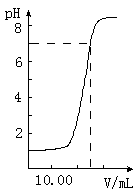
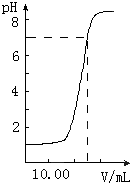
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
| A.盐酸起始浓度为0.1mol?L-1 |
| B.NaOH溶液浓度为0.08mol?L-1 |
| C.滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色 |
| D.滴到中和点时,耗NaOH物质的量为0.002mol |

A.当V(NaOH)=0时,pH=1,则盐酸起始浓度为0.1mol?L-1,故A正确;
B.当加入NaOH25mL时,二者恰好完全反应,则有20×10-3L×0.1mol?L-1=25×10-3L×c(NaOH),c(NaOH)=0.081mol?L-1,故B正确;
C.滴入碱量为20mL时,酸过量,反应后c(H+)=
=0.01mol/L,pH=2,向混合溶液中滴入2滴甲基橙试液,溶液显红色,故C错误;
D.n(HCl)=20×10-3L×0.1mol?L-1=0.002mol,则滴到中和点时,耗NaOH物质的量为0.002mol,故D正确.
故选C.
B.当加入NaOH25mL时,二者恰好完全反应,则有20×10-3L×0.1mol?L-1=25×10-3L×c(NaOH),c(NaOH)=0.081mol?L-1,故B正确;
C.滴入碱量为20mL时,酸过量,反应后c(H+)=
| 0.02L×0.1mol/L-0.02L×0.08mol/L |
| 0.04L |
D.n(HCl)=20×10-3L×0.1mol?L-1=0.002mol,则滴到中和点时,耗NaOH物质的量为0.002mol,故D正确.
故选C.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
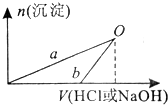 某同学研究铝及其化合物的性质设计了如下两个实验方案.
某同学研究铝及其化合物的性质设计了如下两个实验方案.方案①:2.7gAl 100mLHCl X溶液 NaOH 氢氧化铝沉淀
方案②:2.7gAl 100mLNaOH Y溶液 HCl 氢氧化铝沉淀
NaOH和HCl的浓度均是3mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
| A、b曲线表示的是向x溶液中加入NaOH溶液 | B、在O点时两方案中所得溶液浓度相等 | C、a、b曲线表示的反应都是非氧化还原反应 | D、Y溶液显碱性 |
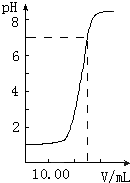 如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )