题目内容
17.下列说法正确的是( )| A. | 标准状况下,任何气体的摩尔体积都约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 标准状况下,1molH2和O2混合气体的体积约为22.4 L | |
| D. | 标准状况下,11.2L水中含有分子的数目为0.5NA |
分析 A.根据气体摩尔体积的概念判断;
B.依据:pV=nRT,物质的量一定时,影响气体体积的因素有压强、温度;
C.标准状况下,气体摩尔体积为22.4L/mol,气体摩尔体积适用于混合气体;
D.气体摩尔体积使用对象为气体.
解答 解:A.标况下,1mol任何气体物质的体积都约为22.4L,包括纯净物和混合物,故A正确;
B.物质的量一定时,影响气体体积的因素有压强、温度,1mol气体的体积是22.4 L,所处状态不一定是标准状况,故B错误;
C.气体摩尔体积适用于混合气体,标准状况下,气体摩尔体积为22.4L/mol,1mol H2和O2的混合气体的体积是22.4 L,故C正确;
D.标况下水是液体,不能使用气体摩尔体积,故D错误;
故选:AC.
点评 考查气体摩尔体积、阿伏伽德罗定律及推论,难度不大,注意气体摩尔体积的使用条件与对象,可以根据pV=nRT理解阿伏伽德罗定律及推论.

练习册系列答案
相关题目
7.已知:SO32-+Br2+H2O→SO42-+2Br-+2H+.某溶液中可能含有Na+、NH4+、Fe2+、K+、Br-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量氯水,溶液仍呈无色.下列关于该溶液的判断正确的是( )
| A. | 肯定不含Br- | B. | 无法确定SO42-是否存在 | ||
| C. | 肯定含有Na+ | D. | 肯定含有SO32- |
8.下列叙述正确的是( )
| A. | 需要加热的反应说明它是吸热反应 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
5.关于如图所示①、②两个装置的叙述中,正确的是( )
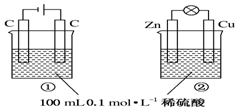

| A. | 硫酸浓度变化:①增大,②减小 | |
| B. | 装置名称:①是原电池,②是电解池 | |
| C. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑②中正极:Zn-2e-═Zn2+ | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
12.下列混合物能用过滤法分离的是( )
| A. | 酒精和水 | B. | 食盐和蔗糖 | C. | 泥沙和食盐水 | D. | 铜粉和铝粉 |
9.下列叙述正确的是( )
| A. | 2 mol H2O的质量为36g/mol | B. | CH4的摩尔质量16 | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 1 mol任何物质体积均为22.4L |
6.为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合物中加入某些物质,下列判断不正确的是( )
| A. | 加入少量NaCl固体,v(H2)不变 | B. | 加入少量水,v(H2)减小 | ||
| C. | 加入少量CH3COONa固体,v(H2)不变 | D. | 加入少量CuSO4溶液,v(H2)变大 |
7.加压降温可以使空气液化,在此过程中,下列说法正确的是( )
| A. | 空气中的分子质量变大 | B. | 空气中的分子间隔变小 | ||
| C. | 空气中的分子种类改变 | D. | 空气中的分子数目变少 |