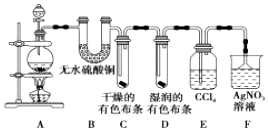
题目内容
5.实验室需要450mL0.2mol•L-1的硫酸,现用质量分数为98%、密度为1.84g•cm-3的浓硫酸来配制.请回答下列问题:(1)所需的仪器除了玻璃棒、烧杯、量筒,还可能用到的玻璃仪器是:500mL容量瓶、胶头滴管
(2)配制溶液时,一般可以分为以下几个步骤:
①量取 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为②①③⑧⑤⑥⑦④.
(3)经计算,需浓硫酸的体积为5.4mL;
(4)在容量瓶的使用方法中,下列操作不正确的是(填编号)BCD.
A.往容量瓶中转移溶液时应用玻璃棒引流
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接沿玻璃棒引流至容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次.
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)配制一定物质的量浓度硫酸溶液的一般步骤有:计算、量取、稀释、冷却移液、洗涤、定容、摇匀,据此排序;
(3)依据C=$\frac{1000ρω}{M}$浓硫酸的物质的量浓度;根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;
(4)A.容量瓶瓶颈较细,为防止液体洒出,应用玻璃棒引流;
B.容量瓶用蒸馏水洗净后,不能够使用待配溶液润洗,否则导致配制的溶液浓度偏高;
C.依据容量瓶使用注意事项解答;
D.依据容量瓶使用注意事项解答;
E.摇匀时,盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次.
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、容量瓶,需要450mL0.2mol•L-1的硫酸应选择500mL容量瓶,所以还缺少的仪器:500mL容量瓶、胶头滴管;
故答案为:500mL容量瓶、胶头滴管;
(2)配制一定物质的量浓度硫酸溶液的一般步骤有:计算、量取、稀释、冷却移液、洗涤、定容、摇匀,所以正确的操作顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(3)质量分数为98%、密度为1.84g•cm-3的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸溶液的体积为V,则根据溶液稀释前后溶质的物质的量不变:0.2mol•L-1×500ml=V×18.4mol/L,解得:V=5.4mL;
故答案为:5.4mL;
(4)A.容量瓶瓶颈较细,为防止液体洒出,应用玻璃棒引流,故A正确;
B.容量瓶用蒸馏水洗净后,不能够使用待配溶液润洗,否则导致配制的溶液浓度偏高,实验失败,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
D.容量瓶为精密仪器,不能用来稀释浓溶液,故D错误;
E.定容完成后,需要摇匀配制的溶液,方法为:盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,故E正确;
故选:BCD.
点评 本题主要考查了配制一定物质的量浓度溶液的操作步骤和仪器方法,明确配制原理及容量瓶使用方法是解题关键,题目难度不大.

①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ②③④ | D. | 全部 |
| A. | 物质的量就是物质的数量 | |
| B. | 物质的量就是物质的摩尔质量 | |
| C. | 物质的量就是物质所含微粒数目的多少 | |
| D. | 物质的量是一种基本物理量 |
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 等量的Zn分别与足量的稀硫酸和浓硫酸反应所得气体体积相同 | |
| C. | Li、Na、K的原子半价和熔沸点随原子序数的增加而增大 | |
| D. | P、C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
| A. | 碳化硅(SiC) | B. | 乙酸(CH3COOH) | C. | 乙烯(C2H4) | D. | 酒精 |
| 选项 | 离子方程式 | 评价 |
| A | 将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O | 正确,Fe2+与Fe3+物质的量之比为1:2 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应Ba2++HCO3 -+OH-═BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
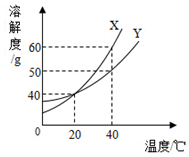 X、Y两种固体的溶解度曲线见图.
X、Y两种固体的溶解度曲线见图.