题目内容
12.写出下列反应的热化学方程式.(1)16gCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1.
(2)1L1mol•L-1KOH溶液中和1L1mol•L-1HNO3溶液,放出57.3kJ热量:KOH(aq)+HNO3(aq)═KNO3(aq)+H2O(l)△H=-57.3kJ•mol-1.
(3)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1.
(4)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
分析 (1)在25℃、101kPa下,16g甲烷(CH4)的物质的量为1mol,燃烧时消耗2mol氧气生成CO2和液态水时放热890.3kJ,书写热化学方程式时要标明物质的聚集状态;
(2)依据酸碱中和反应的定义要点和热化学方程式的书写原则得到,1L 1mol•L-1 KOH溶液中和1L 1mol•L-1 HNO3溶液恰好反应生成1mol水,反应放出的热量为中和热;
(3)根据每生成23gNO2即0.5molNO2需要吸收16.95kJ热量,结合热化学方程式的书写方法结合热化学方程式的意义来回答;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)1mol甲烷完全燃烧生成二氧化碳和液态水放热890.3KJ;故燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
(2)1L 1mol•L-1 KOH溶液中和1L 1mol•L-1 HNO3溶液,反应生成1mol水,放出57.3kJ热量,反应的热化学方程式为:KOH(aq)+HNO3(aq)═KNO3(aq)+H2O(l)△H=-57.3 kJ•mol-1 ,
故答案为:KOH(aq)+HNO3(aq)═KNO3(aq)+H2O(l)△H=-57.3 kJ•mol-1;
(3)适量的N2和O2完全反应,每生成23克NO2即0.5molNO2要吸收16.95kJ热量,所以每生成2molNO2需要吸收67.8kJ热量,则热化学方程式为:
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1;
(4)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| A. | 镁铝合金与盐酸反应转移电子数为0.2NA | |
| B. | x=2y | |
| C. | 沉淀为Mg(OH)2和Al(OH)3的混合物 | |
| D. | a的取值范围为0.9<a<1.2 |
| A. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的钠保存在煤油中 |
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热233kJ•mol-1 |
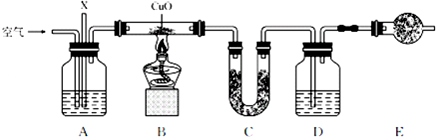
(1)若A装置中所盛放的药品是浓NaOH 溶液,装置A的作用有:
①除去空气中的CO2气体;
②调节X和空气的通入速率,保证O2过量
(2)D装置中所盛放的药品是浓NaOH溶液,
(3)E装置的作用是防止空气中的二氧化碳和水蒸气进入装置D,对结果产生影响,
(4)上述装置中有一处缺陷,请改正在A、B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干燥管.
(5)若实验装置经过改正后,得到的实验数据如下:
| 质量 | 实验前 | 实验后 |
| 药品+U形管的质量/g | 101.1 | 102.9 |
| 药品+广口瓶D的质量/g | 312.0 | 314.2 |
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钡与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钠溶液与硫酸铜溶液反应 2OH-+Cu2+═Cu(OH)2↓ |
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗放出碘的苯溶液 | |
| D. | 在溴化钠中加入少量的乙醇,再加入2倍于乙醇的1﹕1的硫酸制取溴乙烷 |