题目内容
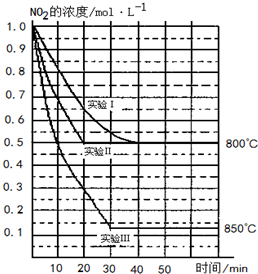
800℃时,某反应达到平衡,平衡常数K= 。恒容时,温度降低,NO浓度减小。下列说法正确的是
。恒容时,温度降低,NO浓度减小。下列说法正确的是
 。恒容时,温度降低,NO浓度减小。下列说法正确的是
。恒容时,温度降低,NO浓度减小。下列说法正确的是 [ ]
A .该反应是焓变为负值
B .恒温恒容下,通入Ar气以增大压强,则平衡右移
C .升高温度,逆反应速率减小
D .该反应化学方程式为2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
B .恒温恒容下,通入Ar气以增大压强,则平衡右移
C .升高温度,逆反应速率减小
D .该反应化学方程式为2NO2(g)
 2NO(g)+O2(g)
2NO(g)+O2(g)A

练习册系列答案
相关题目
 某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)
某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g) 2NO2(g);△H=-12.5aKJ?mol-1
2NO2(g);△H=-12.5aKJ?mol-1