题目内容
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示: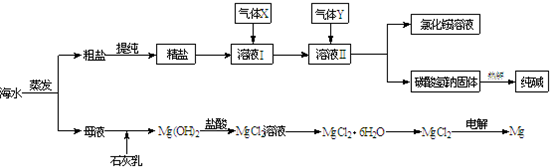
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;
②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
(2)溶液Ⅱ中发生反应的化学方程式是:
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用
(4)高温灼烧六水合氯化镁晶体(MgCl2?6H2O)所得固体是氧化镁,试写出该反应的化学方程式
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;
②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
过滤
过滤
;⑥加适量的盐酸;⑦蒸发结晶
蒸发结晶
.(2)溶液Ⅱ中发生反应的化学方程式是:
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
.(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用
MgCl2
MgCl2
溶液进行洗涤以除之.(4)高温灼烧六水合氯化镁晶体(MgCl2?6H2O)所得固体是氧化镁,试写出该反应的化学方程式
MgCl2?6H2O=MgO+2HCl↑+5H2O↑
MgCl2?6H2O=MgO+2HCl↑+5H2O↑
.(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.分析:粗盐提纯时加入的试剂均为过量,为了防止引入新杂质钡离子,加氯化钡溶液一定要在碳酸钠之前,生成沉淀要过滤后才可以调PH值,否则生成的沉淀又会重新回到溶液中,氯化钠溶液得到晶体的过程使蒸发结晶.氯碱工业的步骤和反应方程式的书写,海水中提取溴相关的化学反应方程式和离子方程式的书写等
解答:解:(1)将生成的硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀从溶液中除去用过滤的方法;氯化钠和盐酸的混合溶液得到氯化钠晶体,可以用蒸发结晶的方法,除去溶液中的氯化氢和水;故答案为:过滤;蒸发结晶;
(2)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)Mg(OH)2 和Ca(OH)2 两种沉淀中氢氧化镁溶解度更小,可以加入 MgCl2 使Ca(OH)2 转化为 Mg(OH)2 沉淀,
故答案为:MgCl2
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2?6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,
故答案为:MgCl2?6H2O=MgO+2HCl↑+5H2O↑;
(5)通入氯气可提取海水中的溴,发生的是置换反应,一换一,Cl2和Br-反应生成2Cl-和Br2,
故答案为:Cl2+2Br-=2Cl-+Br2
(2)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)Mg(OH)2 和Ca(OH)2 两种沉淀中氢氧化镁溶解度更小,可以加入 MgCl2 使Ca(OH)2 转化为 Mg(OH)2 沉淀,
故答案为:MgCl2
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2?6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,
故答案为:MgCl2?6H2O=MgO+2HCl↑+5H2O↑;
(5)通入氯气可提取海水中的溴,发生的是置换反应,一换一,Cl2和Br-反应生成2Cl-和Br2,
故答案为:Cl2+2Br-=2Cl-+Br2
点评:本题考查了氯碱工业,从海水中得到的粗盐进行提纯,进一步用于氯碱工业,与氨气和二氧化碳反应,根据溶解度的不同,析出碳酸氢钠,同时得到副产物氯化铵;副产物氯化镁可以进一步制取金属镁等工业步骤的综合应用等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目





