题目内容
一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2.则下列说法中正确的是( )
| A、通CO的一极是电池的正极 |
| B、负极电极反应是:O2+2CO2+4e-=2CO32- |
| C、熔融盐中CO32-的物质的量在工作时保持不变 |
| D、正极发生氧化反应 |
考点:化学电源新型电池
专题:电化学专题
分析:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-.
解答:
解:A、该燃料电池中通入CO的一极是负极,通O2和CO2的混合气体的一极是正极,故A错误;
B、该燃料电池中通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,故B错误;
C、正极上的电极反应式为O2+4e-+2CO2═2CO32-,负极上的电极反应式为2CO-4e-+2CO32-═4CO2,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,故C正确;
D、在原电池中,正极上氧气得电子发生还原反应,故D错误;
故选:C.
B、该燃料电池中通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,故B错误;
C、正极上的电极反应式为O2+4e-+2CO2═2CO32-,负极上的电极反应式为2CO-4e-+2CO32-═4CO2,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,故C正确;
D、在原电池中,正极上氧气得电子发生还原反应,故D错误;
故选:C.
点评:本题考了查原电池原理,根据燃料电池的工作原理规律来分析解答即可,注意把握正负极的判断及电极反应式的书写方法,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案
相关题目
大量服用阿司匹林会导致( )
| A、便秘 |
| B、食欲不振、缺乏抵抗力 |
| C、腹泻 |
| D、胃溃疡、胃出血 |
下列有关物质用途的说法中,正确的是( )
| A、玻璃容器可长期盛放各种酸 |
| B、硝酸常用作金属铜加工前的酸洗 |
| C、碳酸钠可用于治疗胃酸过多 |
| D、三氧化二铁常用于生产红色油漆和涂料 |
下列叙述或操作正确的是( )
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、硝酸常温下能与铜反应,说明硝酸有强氧化性 |
某溶液中含有较大量的四种离子,在其中加入稀硫酸后它们的物质的量几乎不发生变化.这四种离子可能是( )
| A、Na+、Ag+、ClO-、Cl- |
| B、Al3+、Mg2+、Br-、Cl- |
| C、NH4+、NO3-、Fe2+、SO42- |
| D、K+、Ba2+、NO3-、OH- |
图甲和图乙表示的是元素的某种性质随原子序数的变化.下列说法正确的是( )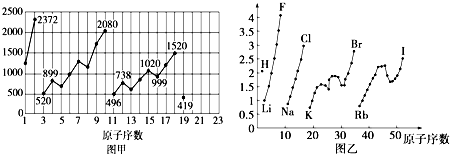

| A、图甲可能表示的是元素原子的第一电离能随原子序数的变化关系 |
| B、图甲可能表示的是元素单质的熔点随原子序数的变化关系 |
| C、图乙可能表示的是元素原子的半径随原子序数的变化关系 |
| D、图乙不可能表示元素的电负性随原子序数的变化关系 |
