题目内容
17.某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化.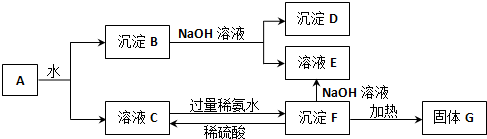
请回答下列问题:
(1)图中分离沉淀B与溶液C的方法是过滤.
(2)D、E、F这3种物质的化学式分别为:
D:Fe2O3 E:NaAlO2 F:Al(OH)3
(3)沉淀B与NaOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;溶液C与过量稀氨水反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)检验溶液中是否含有Fe3+,最佳试剂是KSCN溶液,现象为溶液变成血红色.
分析 KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中C中含KAl(SO4)2,沉淀B是Al2O3和Fe2O3;
向沉淀B中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则D为Fe2O3,溶液E中含NaAlO2、NaOH;
向溶液C中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到F为Al(OH)3,Al(OH)3加热生成G为Al2O3,以此来解答.
解答 解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中C中含KAl(SO4)2,沉淀B是Al2O3和Fe2O3;
向沉淀B中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则D为Fe2O3,溶液E中含NaAlO2、NaOH;
向溶液C中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到F为Al(OH)3,F与NaOH反应生成E,E为NaAlO2,Al(OH)3加热生成G为Al2O3,
(1)分离沉淀B与溶液C的方法是过滤,故答案为:过滤;
(2)由上述分析可知,D为Fe2O3,E为NaAlO2,F为Al(OH)3,故答案为:Fe2O3;NaAlO2;Al(OH)3;
(3)沉淀B与NaOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;溶液C与过量稀氨水反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)检验溶液中是否含有Fe3+,最佳试剂是KSCN溶液,现象为溶液变成血红色,故答案为:KSCN溶液;溶液变成血红色.
点评 本题考查无机物的推断,为高考常见题型,侧重于考查学生的分析能力和推断能力,把握物质的性质及发生的反应为解答的关键,注意氢氧化铝的两性及元素化合物知识的综合应用,题目难度不大.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 电子层数 | B. | 原子量 | C. | 次外层电子数 | D. | 最外层电子数 |
①溶液呈浅绿色 ②与碱反应生成红褐色沉淀 ③Fe3+既具有氧化性,又具有还原性 ④Fe3+的水溶液滴入KSCN试液后,立即出现红色.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| A. | 金属钠保存在煤油中 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 合金的硬度一般比各成分金属大 | |
| D. | 铜与氯化铁溶液的反应常用于制作印刷电路板 |
| A. | 镁铝合金质量轻、强度大,可用作高铁车厢材料 | |
| B. | 用纸制品、聚乳酸等物质来替代聚乙烯产品,以减少白色污染 | |
| C. | 明矾可用于水的消毒、杀菌 | |
| D. | 大量燃烧化石燃料,是造成雾霾天气的一种原因 |
| A. | 金属钠属于危化品中的易燃固体,其着火时不能用水灭火 | |
| B. | 氰化钠( NaCN)是一种剧毒危险品,其水溶液呈碱性 | |
| C. | 实验室里可将少量的钠保存于煤油中 | |
| D. | NH4N03、NaCN、CaC2中均含有离子键和非极性共价键 |
| A. | pH=7的溶液中:K+、Na+、Fe3+、SO42- | |
| B. | 饱和NaHCO3溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、I-、NO3-、HCO3- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、Zn2+、Br-、I- |
| A. | 用纯净的乙烯合成的聚乙烯是纯净物 | |
| B. | 聚乙烯可以人工合成,也可以是天然高分子化合物 | |
| C. | 聚乙烯高温分解,生成其单体--乙烯 | |
| D. | 聚乙烯的单体能够使溴的四氯化碳溶液褪色 |
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: