题目内容
7.下列关于电解质溶液的叙述正确的是( )| A. | 常温下,PH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| B. | pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| C. | 在PH相同的盐酸和氯化铵溶液中水的电离程度相同 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$增大 |
分析 A.常温下,pH=7的溶液中c(H+)=c(OH-),根据电荷守恒判断;
B.醋酸是弱电解质存在电离平衡,pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,混合液中醋酸过量,溶液呈酸性;
C.盐酸抑制了水的电离,氯化铵中铵离子促进了水的电离;
D.向0.1mol/L的氨水中加入少量硫酸铵固体,抑制一水合氨电离.
解答 解:A.常温下,pH=7的溶液中c(H+)=c(OH-),溶液中存在电荷守恒,所以c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+),故A错误;
B.pH=3的醋酸溶液中,醋酸的浓度大于0.001mol/L,pH=11的氢氧化钠溶液的浓度为0.001mol/L,两溶液等体积混合后醋酸过量,溶液呈酸性,则溶液的pH<7,滴入石蕊溶液呈红色,故B正确;
C.盐酸抑制了水的电离,而氯化铵溶液中铵离子水解,促进了水的电离,所以两溶液中水的电离程度不相同,故C错误;
D.向0.1mol/L的氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制一水合氨电离,溶液中氢氧根离子浓度减小、一水合氨分子浓度增大,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故D错误;
故选B.
点评 本题考查了水的电离、溶液pH的简单计算,题目难度中等,注意明确氢离子与溶液的pH的转化关系,注意酸溶液和碱溶液抑制了水的电离,而能够水解的盐能够促进水的电离.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
17.下列措施不利于节能减排、改善环境质量的有( )
| A. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 | |
| B. | 使用填埋法处理未经分类的生活垃圾 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 加速建设地铁、轻轨等轨道交通,促进武汉“8+1”城市圈-体化发展,减少汽车尾气排放 |
18.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 油脂在空气中完全燃烧转化为水和二氧化碳 |
15.从海带中提取碘,可经过一下实验不走完成.
海带$\stackrel{灼烧}{→}$海带灰$→_{溶解}^{30mL蒸馏水}$ $\stackrel{蒸沸}{→}$$\stackrel{过滤}{→}$ 滤液$→_{氧化}^{2mL稀H_{2}SO_{4},5mLH_{2}O_{3}}$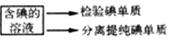
( )
海带$\stackrel{灼烧}{→}$海带灰$→_{溶解}^{30mL蒸馏水}$ $\stackrel{蒸沸}{→}$$\stackrel{过滤}{→}$ 滤液$→_{氧化}^{2mL稀H_{2}SO_{4},5mLH_{2}O_{3}}$
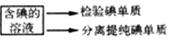
( )
| A. | 在灼烧过程中使用的玻璃仪器有酒精灯、玻璃棒、坩埚 | |
| B. | 在上述氧化过程中发生反应的离子方程式为2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
2.下列元素属于ds区的是( )
| A. | Ca | B. | Fe | C. | Cu | D. | P |
12.某烃分子中含有一个双键和一个叁键,则它的分子式可能是( )
| A. | C4H6 | B. | C5H6 | C. | C7H8 | D. | C10H8 |
19.常见的有机反应类型有:①取代②加成③消去④脂化⑤加聚⑥水解⑦还原,其中能在有机物分子中引入-OH的反应类型有( )
| A. | ①②③④⑤⑥ | B. | ③④⑥⑦ | C. | ①②⑥⑦ | D. | ②③④⑤ |
18.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |