题目内容
6. 为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0kJ/mol
NO2(g)═$\frac{1}{2}$N2O4(g)△H=-28.5kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810kJ/mol.
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=0.075mol/(L•s);达到平衡时NO2转化率=75%;计算该温度下该反应的化学平衡常数K=1.8(填数值).
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g)$\stackrel{一定条件}{?}$CO(NH2)2(s)+H2O(g)△H
该反应在一定条件下能自发进行的原因是△H<0;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是bd(填序号).
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域.有人利用如图所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95%以HCO3-存在),有利于减少环境中温室气体含量.
①a室的电极反应式为2H2O-4e-=4H++O2↑.
②b室中提取CO2的反应的离子方程式为H++HCO3-=CO2↑+H2O.
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海.处理的方法是用c室排出的碱性溶液将从b室排出的酸性海水调节至接近正常海水的pH.
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(2)通过平衡“三行式”利用公式计算速率、转化率和平衡常数;
(3)可逆反应:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△S<0,根据△G=△H-T△S判断;
反应前后改变的物理量不变时,可逆反应达到平衡状态;若想提高氨气的转化率,平衡正向进行;
(4)①a室接电源的正极,为阳极,水失去电子生成氧气和氢离子;
②氢离子通过阳离子交换膜进入b室,与b室中的碳酸氢根反应生成二氧化碳气体,据此解答即可;
③c室连接电源的负极,为阴极,水得到电子生成氢气和氢氧根,a室中产生氢离子,用c室排除的碱液将从b室排出的酸性海水调节即可,据此解答.
解答 解:(1)已知:Ⅰ、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
Ⅱ、2NO2(g)?N2O4(g)△H2=-57kJ/mol
根据盖斯定律,Ⅰ-Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-57kJ/mol)=-810kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=-810kJ/mol,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810kJ/mol;
(2)NO2(g)+SO2(g)═SO3(g)+NO(g)
起始物质的量浓度(mol/L) 1 2 0 0
变化物质的量浓度(mol/L) 0.75 0.75 0.75 0.75
平衡物质的量浓度(mol/L) 0.25 1.25 0.75 0.75
则10s内反应的平均速率v(SO2)=$\frac{0.75mol/L}{10s}$=0.075 mol/(L•s);
达到平衡时NO2转化率=$\frac{0.75mol/L}{1mol/L}×100%$=75%;
该温度下该反应的化学平衡常数K=$\frac{0.75×0.75}{0.25×1.25}$=1.8;
故答案为:0.075 mol/(L•s);75%;1.8;
(3)2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△S<0,此反应能自发进行,即△G=△H-T△S<0,则△H<0;
2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0,反应是气体体积减小的放热反应;
a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;
b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;
c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;
d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故d正确;
故答案为:△H<0;bd;
(4)①a室为阳极,发生氧化反应,电极方程式为2H2O-4e-=4H++O2↑,故答案为:2H2O-4e-=4H++O2↑;
②氢离子通过阳离子交换膜进入b室,发生反应H++HCO3-=CO2↑+H2O,故答案为:H++HCO3-=CO2↑+H2O;
③c室发生2H2O+2e-=2OH-+H2↑,可用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,以达到排放标准,
故答案为:用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH.
点评 本题考查较为综合,涉及盖斯定律的应用、电解原理的应用、氧化还原反应、化学平衡的计算及化学平衡状态判断等,为高考常见题型和高频考点,侧重于学生的分析能力以及对基础知识的综合应用能力的考查,题目难度中等.

| A. | 充分利用太阳能,进行海水淡化 | |
| B. | 将秸秆露天焚烧,从而充分利用生物质能 | |
| C. | 以二氧化硅为光电池材料,将太阳能转化为电能 | |
| D. | 用甲烷与水作用生产清洁能源--H2,该过程的原子利用率为100% |
| A. | 过量 Cl2:Fe2+、H+、Al3+、Cl-、SO42- | |
| B. | 过量SO2:Fe2+、H+、Al3+、SO42- | |
| C. | 过量氨水:NH4+、AlO2-、SO42-、OH- | |
| D. | 过量 Na2O2:Na+、Fe3+、SO42-、OH- |
| A. | 用硫酸清洗锅炉中的水垢 | |
| B. | Na2O2 用作呼吸面具的供氧剂 | |
| C. | 氯水中通入SO2 后溶液的酸性减弱 | |
| D. | N2 与O2 在放电条件下直接化合生成NO2 |
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | S2-的结构示意图: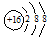 | ||
| C. | CaO2的电子式: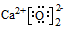 | D. | 葡萄糖的结构简式:C6H12O6 |
| A. | 可以观察到酸性高锰酸钾溶液褪色 | |
| B. | 溴乙烷能发生消去反应 | |
| C. | 该实验现象不能说明产生的气体中一定有乙烯 | |
| D. | 向反应后溶液中滴加AgNO3溶液可验证Br-的存在 |
| A. | Cu(NO3)2 | B. | HCl | C. | MgCl2 | D. | Na2SO4 |
| A. | 氯气 | B. | 碘水 | C. | 氯化钠溶液 | D. | 溴水 |
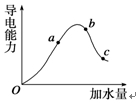 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题: