题目内容
16.常温下,下列溶液中各组离子一定能大量共存的是( )| A. | 使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- | |
| B. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
分析 A.使甲基橙呈红色的溶液,显酸性;
B.由水电离产生的c(H+)=10-12mol•L-1的溶液,为酸或碱溶液;
C.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液,显酸性;
D.$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液,显碱性.
解答 解:A.使甲基橙呈红色的溶液,显酸性,不能大量存在AlO2-、CO32-,故A错误;
B.由水电离产生的c(H+)=10-12mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在HCO3-,碱溶液中不能大量存在HCO3-、NH4+,故B错误;
C.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液,显酸性,不能大量存在ClO-,故C错误;
D.$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
6.向下列溶液中通入过量的CO2,有沉淀产生的是( )
| A. | 澄清的石灰水 | B. | 饱和碳酸钠溶液 | C. | 氯化钙溶液 | D. | 硝酸钡溶液 |
7.可逆反应:2A(g)+2B(g)?C(g)+3D(g) 在不同情况下测得下列4种反应速率,其中反应最快的是( )
| A. | v(A)=0.45mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.5mol/(L•min) | D. | v(D)=0.4mol/(L•s) |
11.一定由两种元素组成的物质是( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
1.某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
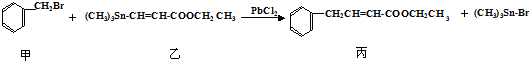
下列分析判断正确的是( )

下列分析判断正确的是( )
| A. | 分离提纯有机物丙宜在NaOH热溶液中进行 | |
| B. | PbCl2的作用是提高反应物的活性,加快反应速率 | |
| C. | 可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 | |
| D. | 利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
8.已知:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系不正确的是( )
| A. | 4v(NH3)=5v(O2) | B. | 6v(O2)=5v(H2O) | C. | 3v(NH3)=2v(H2O) | D. | 4v(O2)=5v(NO) |
5.下列反应的离子方程式书写不正确的是( )
| A. | 实验室制取氯气 MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 过量的氨水滴加到氯化铝溶液中 Al3++3NH3.H2O═Al(OH)3↓+3NH4+ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+H++HClO | |
| D. | 小苏打溶液中加入过量石灰水2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
6.下列气体中,有毒、能污染大气,可以用氢氧化钠溶液吸收的是( )
| A. | Cl2 | B. | CO2 | C. | CO | D. | NH4 |