题目内容
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.

(1)A中反应的离子方程式为 .
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH(填“增大”、“减小”或“不变”) .
(3)C中被腐蚀的金属是 ,总反应式为 .
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 .

(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为
(3)C中被腐蚀的金属是
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
考点:原电池和电解池的工作原理
专题:
分析:(1)铁的化学性质,能与酸反应;
(2)根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
(3)根据金属活泼性判断原电池的正负极,得出正确结论;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
(2)根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
(3)根据金属活泼性判断原电池的正负极,得出正确结论;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答:
解:(1)铁与硫酸反应的离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
(3)锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑,
故答案为:锌;Zn+2H+=Zn2++H2↑;
(4)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,故答案为:B>A>C.
(2)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
(3)锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑,
故答案为:锌;Zn+2H+=Zn2++H2↑;
(4)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,故答案为:B>A>C.
点评:原电池几乎是高考不变的一个题型,每年高考中必考,是热点题型.本题考查了原电池的工作原理和电极反应式的书写以及金属的活泼性.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列说法正确的是( )
A、常温下
| ||
| B、向碳酸氢钙溶液中加入过量氢氧化钠溶液发生反应的离子方程式可表示为:Ca2++HCO3-+OH-═CaCO3↓+H2O | ||
| C、加入铝能放出H2的溶液中一定能大量存在Cu2+、Na+、NO3-、C1?四种离子 | ||
| D、常温下将0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) |
铝用作焊接钢轨是利用( )
| A、铝同氧气反应生成稳定的保护层 |
| B、铝是热的良导体 |
| C、铝合金强度大 |
| D、铝是强还原剂,铝热反应放热 |
某无色溶液能与铝作用生成H2,则溶液中一定可以大量共存的离子组是( )
| A、Cl-、Ba2+、Mg2+、ClO- |
| B、Cl-、SO42-、Cu2+、Mg2+ |
| C、Cl-、SO42-、K+、Na+ |
| D、HCO3-、NO3-、Na+、Cl- |
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z原子的最外层电子数是其内层电子数的3倍.下列说法正确的是( )
| A、元素Z、W的简单离子的电子层结构不同 |
| B、元素的非金属性由强到弱:Y>Z>X |
| C、只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| D、元素Y的气态氢化物与其最高价氧化物对应的水化物不反应 |
标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于( )
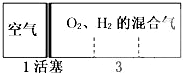
①2:7 ②5:4 ③4:5 ④7:2.
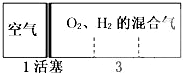
①2:7 ②5:4 ③4:5 ④7:2.
| A、①② | B、②④ | C、③④ | D、①③ |
对可逆反应4A(g)+5B(g)?4C(g)+6D(g)△H>0,下列叙述中,正确的是( )
| A、化学反应速率关系是:2v正(A)=3v正(D) |
| B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态 |
| C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大 |
| D、达到化学平衡后,升高温度,则C的质量分数增大 |
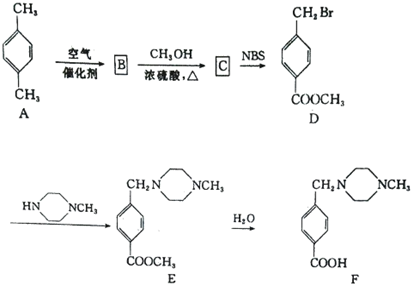
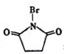 ,则反应C→D的化学方程式为
,则反应C→D的化学方程式为