题目内容
在容积为 1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:CO(g)+2H2(g) CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
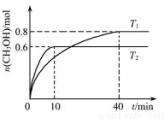
A.T1>T2
B.K(T1)>K(T2)
C. T1温度下达到平衡后,再充入一定量CO,CO的转化率增大
T1温度下达到平衡后,再充入一定量CO,CO的转化率增大
D.T2温度下,0~10min间v(H2)=0.06mol·L-1·min-1
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案| A. | H2S和NH3均是价电子总数为8的极性分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CH2Cl2和CCl4均是四面体构型的非极性分子 | |
| D. | SO2和SO3来化轨道类型均为sp2杂化,空间构型分别为V形、平面三角形 |
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O2 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
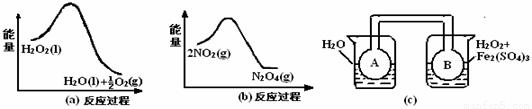
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是_______________。
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L


 下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·m
2NH3(g) △H=-38.6kJ·m ol-1
ol-1