题目内容
19.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签 上的部分内容.据此下列说法错误的是( )
| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 该硫酸常用做干燥剂 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
分析 A、根据c=$\frac{1000ρω}{M}$计算该浓硫酸的物质的量浓度;
B、由A该硫酸是浓硫酸,可以做干燥剂;
C、根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸的体积;
D.浓硫酸密度大于水,所以等质量混合时硫酸浓度小于原来一半.
解答 解:A、该浓硫酸物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A正确;
B、由A该硫酸是浓硫酸,可以做干燥剂,故B正确;
C、令需浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则200mL×4.6 mol/L=V×18.4mol/L,解得V=50mL,故C正确;
D.浓硫酸密度大于水,所以等质量的浓硫酸和水混合体积大于浓硫酸的2倍,所以混合时硫酸浓度小于原来一半,故D错误;
故选D.
点评 本题考查物质的量浓度、质量分数的有关计算,难度中等,注意公式的灵活运用,注意D选项中浓度影响物质性质关系.

练习册系列答案
相关题目
9.下列化合物中,属于酸式盐的是( )
| A. | NaCl | B. | NaHCO3 | C. | Cu(OH)2 | D. | H2SO4 |
10.把等物质的量的CuSO4、FeCl3和锌粉置于足量的水中,充分反应,反应后的溶液中大量存在的金属阳离子是( )
| A. | Cu2+、Fe3+、Fe2+、Zn2+ | B. | Fe3+、Fe2+、Zn2+ | ||
| C. | Cu2+、Fe3+、Zn2+ | D. | Cu2+、Fe2+、Zn2+ |
7.下列有关NA叙述正确的是( )
| A. | 标准状况下,1molSO3的气体体积为22.4L | |
| B. | 1mol铁粉与过量Cl2反应时,转移电子数为2NA | |
| C. | 含有2NA个氧原子的D2O质量为40g | |
| D. | 16gO2分子中含有的氧原子数为0.5NA |
14.铁铜单质及其化合物的应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
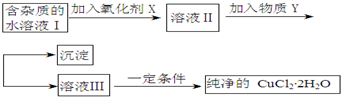
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)下列最适合作氧化剂X的是C
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入的物质Y是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3]如果不用物质Y而直接用可溶性碱溶液不能 (填“能”或者“不能”)达到目的.若不能,试解释原因加碱使Fe3+沉淀的同时也能使Cu2+沉淀(若填“能”,此空不用回答)
(3)最后不能(填“能”或者“不能”)直接蒸发得到CuCl2•2H2O?若不能,应该如何操作才能得到CuCl2•2H2O应在HCl气流中加热蒸发结晶(若填“能”,此空不用回答)
(4)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀
(5)若向溶液Ⅱ中加入镁粉,产生的气体是氢气,试解释原因镁粉与氯化铁、氯化铜水解生成的氢离子反应生成氢气.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(1)下列最适合作氧化剂X的是C
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入的物质Y是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3]如果不用物质Y而直接用可溶性碱溶液不能 (填“能”或者“不能”)达到目的.若不能,试解释原因加碱使Fe3+沉淀的同时也能使Cu2+沉淀(若填“能”,此空不用回答)
(3)最后不能(填“能”或者“不能”)直接蒸发得到CuCl2•2H2O?若不能,应该如何操作才能得到CuCl2•2H2O应在HCl气流中加热蒸发结晶(若填“能”,此空不用回答)
(4)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀
(5)若向溶液Ⅱ中加入镁粉,产生的气体是氢气,试解释原因镁粉与氯化铁、氯化铜水解生成的氢离子反应生成氢气.
11.碱性锌锰电池是一种常见的一次电池,应用非常广泛,其工作时发生如下反应:Zn+2MnO2+H2O=2MnOOH+Zn(OH)2,下列说法正确的是( )
| A. | Zn为负极,MnO2为正极 | |
| B. | Zn为正极,MnO2为负极 | |
| C. | 工作时电子由MnO2经外电路流向Zn极 | |
| D. | Zn电极发生还原反应,MnO2电极发生氧化反应 |

