题目内容
|
在298 K 1.01×l05 Pa下,将32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应.测得反应放出x kJ的热量.已知在该条件下,1 mol SO2通入1 L 2 mol/L KOH溶液中充分反应放出y kJ的热量.则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是 | |
| [ ] | |
A. |
SO2(g)+KOH(aq)=KHSO3(aq) ΔH=-(4x-y)kJ/mol |
B. |
SO2(g)+KOH(aq)=KHSO3(aq) ΔH=-(2x-y)kJ/mol |
C. |
SO2(g)+KOH(aq)=KHSO3(aq) ΔH=-(2y-x)kJ/mol |
D. |
2SO2(g)+2KOH(1)=2KHSO3(1) ΔH=-(8x-2y)kJ/mol |

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案(2011·威海毕业考试)在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500mol/L,c(H2O2)=0.400 mol/L时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/(mol·L-1·s-1) | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
A.0.0380 mol·L-1·s-1 B.0.152mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760mol·L-1·s-1
(2011·威海毕业考试)在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol/L,c(H2O2)=0.400 mol/L时的反应速率为( )
|
实验编号 |
1 |
2 |
3 |
4 |
5 |
|
c(HI)/(mol·L-1) |
0.100 |
0.200 |
0.300 |
0.100 |
0.100 |
|
c(H2O2)/(mol·L-1) |
0.100 |
0.100 |
0.100 |
0.200 |
0.300 |
|
v/(mol·L-1·s-1) |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
0.0228 |
A.0.0380 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1

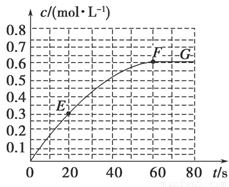
 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。