题目内容
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
| A、容量瓶事先未烘干 |
| B、空盘时天平指针向标尺右边偏转 |
| C、定容时观察液面仰视 |
| D、溶解后立即转移到容量瓶进行定容 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:根据c=
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
| n |
| V |
解答:
解:A、只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故A不选;
B、空盘时天平指针向标尺右边偏转,会导致称量出的KOH的质量偏大,则所配溶液的浓度偏高,故B不选;
C、定容时仰视液面,会导致溶液体积偏大,则浓度偏小,故C选;
D、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故D不选;
故选C.
B、空盘时天平指针向标尺右边偏转,会导致称量出的KOH的质量偏大,则所配溶液的浓度偏高,故B不选;
C、定容时仰视液面,会导致溶液体积偏大,则浓度偏小,故C选;
D、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故D不选;
故选C.
点评:本题考查了一定物质的量浓度溶液的配制过程中的误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol.下列说法不正确的是( )
| A、该反应的反应热△H=-483.6 kJ/mol |
| B、H2的燃烧热△H=-241.8 kJ/mol |
| C、2mol H2完全燃烧生成液态水放出的热量大于483.6 kJ |
| D、形成2 mol H2O的化学键释放的总能量大于断裂2 mol H2和1 mol O2 的化学键所吸收的总能量 |
下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①中和热测定时用稀醋酸和稀氢氧化钠溶液,测得的中和热数值
②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥用标准液滴定未知溶液(放于锥形瓶中)时,滴定管滴定前无气泡滴定后有气泡.
①中和热测定时用稀醋酸和稀氢氧化钠溶液,测得的中和热数值
②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥用标准液滴定未知溶液(放于锥形瓶中)时,滴定管滴定前无气泡滴定后有气泡.
| A、①③⑤⑥ | B、①②⑤⑥ |
| C、②③④⑥ | D、③④⑤⑥ |
下列说法正确的是( )
| A、在“研究反应速率的影响因素”实验中:Na2S2O3+H2SO4=Na2SO4+S+SO2+H2O,可通过观察产生气泡的快慢来比较不同条件下该反应的速率大小 |
| B、为了精确测定盐酸与氢氧化钠溶液反应的反应热,当两者混合后,立即读取温度计的读数,防止热量散失 |
| C、将铁粉、碳粉、少量氯化钠和水混合放在塑料袋中搓揉,用手触摸会感觉到发热,袋里产生大量铁锈 |
| D、酸碱中和滴定实验中,终点判断过迟,导致标准液滴多,只能重新滴定 |
对于可逆反应:mA(g)+nB(g)?xC(g)+yD(s)△H=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如图所示,下列判断正确的是( )


| A、△H>0,m+n>x+y |
| B、△H<0,m+n>x+y |
| C、△H<0,m+n>x |
| D、△H>0,m+n<x |
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.





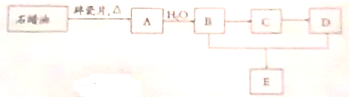
 某化学研究小组为了探究能与二氧化锰反应的盐酸的最低浓度,设计了如图所示的实验装置,向圆底烧瓶中加入20mL 12mol?L-1浓盐酸和足量二氧化锰粉末,加热,已知装置B和C中的试剂都是足量(不考虑反应过程中烧瓶内溶液体积的变化)
某化学研究小组为了探究能与二氧化锰反应的盐酸的最低浓度,设计了如图所示的实验装置,向圆底烧瓶中加入20mL 12mol?L-1浓盐酸和足量二氧化锰粉末,加热,已知装置B和C中的试剂都是足量(不考虑反应过程中烧瓶内溶液体积的变化)