题目内容
(8分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 , K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)
+H2O(g)  CO2(g) +H2 (g)
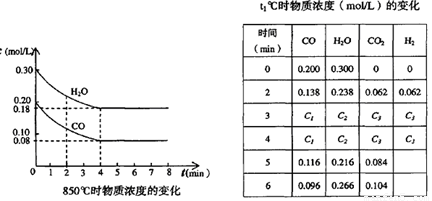
△H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g)
△H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。

①表中3min~4min之间反应处于_________状态;
c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(8分) (1) (每空1分)表示 反应进行程度越大 ,
K值_可能增大也可能减小___。
(2)(每空2分)
速率v(CO)=__0.03___mol·L-1·min-1。
(3)(每空1分)
①表中3min~4min之间反应处于___平衡___状态;
c 1数值_大于___0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是___d___ (单选),表中5min~6min之间数值发生变化,可能的原因是___a____ (单选)
【解析】

 阅读快车系列答案
阅读快车系列答案(2)在一体积为
CO(g)+H2O(g) ![]() CO2(g)+H2(g)+Q(Q>0)
CO2(g)+H2(g)+Q(Q>0)
CO和H2O浓度变化如下图,则0—4 min间平均反应速率v(CO)=____________ mol·L-1·min-1。

t ℃时物质浓度(mol·L-1)的变化
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 |
|
6 | 0.096 | 0.266 | 0.104 |
|
(3)t ℃(高于850 ℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3—4 min之间反应处于_________状态;c1数值_________0.08 mol·L-1(填“大于”“小于”或“等于”)。
②反应在4—5 min间,平衡向逆方向移动,可能的原因是___________(单选),表中5—6 min之间数值发生变化,可能的原因是___________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增大氢气浓度
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________, K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。

T℃时物质浓度(mol·L-1)的变化:
|
时间(min) |
CO |
H2 |
CO |
H2 |
|
0 |
0.200[来源:Zxxk.Com] |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
 CO2(g)十H2 (g) △H<0 CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H<0 CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
 CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”); ,
, ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度
,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度 (正)__________
(正)__________ CO2(g)十H2 (g) △H
< 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H
< 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)