题目内容
17.设NA表示阿伏加德罗常数的值,下列说法错误的是( )| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
分析 A.氧气和臭氧是同素异形体,都是由氧原子构成的分子,每个O原子中含有8个质子,混合气体中n(O)=$\frac{32g}{16g/mol}$=2mol,则质子的物质的量为16mol;
B.n(SO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据N=nNA计算二氧化硫分子个数;
C.Fe和足量硝酸反应生成Fe 3+,和少量硝酸反应生成Fe2+,且铁和浓硝酸发生钝化现象;
D.Na和足量越强充分反应,无论生成Na2O、Na2O2,都是钠失电子作还原剂.
解答 解:A.氧气和臭氧是同素异形体,都是由氧原子构成的分子,每个O原子中含有8个质子,混合气体中n(O)=$\frac{32g}{16g/mol}$=2mol,则质子的物质的量为16mol,则32gO2和O3的混合气体所含质子数一定为16NA,故A正确;
B.n(SO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,N(SO2)=nNA=0.5mol×NA/mol=0.5NA,故B正确;
C.Fe和足量硝酸反应生成Fe 3+,和少量硝酸反应生成Fe2+,且铁和浓硝酸发生钝化现象.硝酸的浓度及硝酸的量未知,无法判断Fe失电子数,故C错误;
D.Na和足量越强充分反应,无论生成Na2O、Na2O2,都是钠失电子作还原剂,每个Na原子失去1个电子生成钠离子,n(Na)=$\frac{23g}{23g/mol}$=1mol,所以23g钠与足量氧气充分反应,转移的电子数一定是NA,故D正确;
故选C.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确物质构成、各个物理量之间的关系、元素化合物性质是解本题关键,易错选项是A,题目难度不大.

练习册系列答案
相关题目
7.部分中学化学常见元素的原子结构和性质如下表所示:
请用元素符号或化学式回答下列问题:
(1)C、D、E的简单离子的半径由大到小的顺序为N3->Na+>Al3+.
(2)B元素有多种同位素,写出其中带8个中子的原子符号146C.
(3)由A和C组成的六原子化合物甲(C2A4)可用作发射卫星时的燃料,用NO2为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)A与C能形成离子化合物A5C,A5C中既含离子键又含共价键,其电子式为 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
(5)E的单质可以和D的最高价氧化物对应的水化物反应,写出其反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,F的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物可以发生反应,试写出其反应的离子方程式3H++Al(OH)3=Al3++3H2O.
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
(1)C、D、E的简单离子的半径由大到小的顺序为N3->Na+>Al3+.
(2)B元素有多种同位素,写出其中带8个中子的原子符号146C.
(3)由A和C组成的六原子化合物甲(C2A4)可用作发射卫星时的燃料,用NO2为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)A与C能形成离子化合物A5C,A5C中既含离子键又含共价键,其电子式为
 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.(5)E的单质可以和D的最高价氧化物对应的水化物反应,写出其反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,F的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物可以发生反应,试写出其反应的离子方程式3H++Al(OH)3=Al3++3H2O.
8.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 铍的氧化物对应的水化物具有两性 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,钠的燃烧产物比铷(Rb)的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
2.化学与生活、社会密切相关.下列说法正确的是( )
| A. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| B. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
7.化学与社会、生活密切相关,下列说法中正确的是( )
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| D. | Fe3O4俗称铁红,常作红色油漆和涂料 |
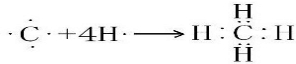 .
.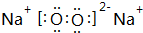 ,用电子式表示该化合物的形成过程
,用电子式表示该化合物的形成过程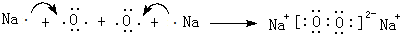 .
. .
. .
.