题目内容
 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是
A.氯化钙受热挥发 B.氯化钙受热分解
C.钙离子中电子跃迁 D.氯离子中电子跃迁
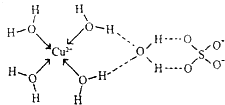
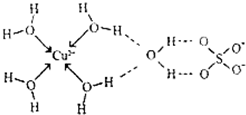
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色.科学家通过X射线舅定出胆矾的结构,其结构可用右图表示.
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是
②铜离子形成胆矾中配位离子的离子方程式为
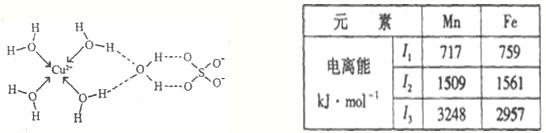
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表.据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因
| 元素 | Mn | Fe | |
| 电离能kJ.mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析:(1)根据电子排布规律分析;
(2)钙元素的焰色反应为砖红色,进行焰色反应时,吸收能量,钙离子电子发生跃迁;
(3)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键;
②铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+;
(4)电离能越大,越不容易失去电子,根据第三电离能可知Mn2+再失去电子比Fe2+更难,电子处于半满、全满、全空是更稳定;
(2)钙元素的焰色反应为砖红色,进行焰色反应时,吸收能量,钙离子电子发生跃迁;
(3)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键;
②铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+;
(4)电离能越大,越不容易失去电子,根据第三电离能可知Mn2+再失去电子比Fe2+更难,电子处于半满、全满、全空是更稳定;
解答:解:(1)第四周期元素中,基态原子的最外层只有1个电子的元素,即4s1,该原子4s能级未填充满,情况之一是按照能级顺序正常填充的结果,1s22s22p63s23p64s1,此为19K元素;情况之二是按照洪特规则的特例填充的结果,1s22s22p63s23p63d54s1,1s22s22p63s23p63d104s1,此为24Cr和29Cu;
故答案为:3;
(2)钙元素进行焰色反应时,吸收能量,钙离子电子发生跃迁,产生发射光谱为砖红色;
故答案为:C;
(3)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键;
故答案为:氢键;离子键;
②铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
(4)Mn的I3=3248 kJ?mo1-1大于Fe的I3=2957 kJ?mo1-1,所以Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
故答案为:Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
故答案为:3;
(2)钙元素进行焰色反应时,吸收能量,钙离子电子发生跃迁,产生发射光谱为砖红色;
故答案为:C;
(3)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键;
故答案为:氢键;离子键;
②铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
(4)Mn的I3=3248 kJ?mo1-1大于Fe的I3=2957 kJ?mo1-1,所以Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
故答案为:Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
点评:本题考查核外电子排布式、化学键、原子的结构与性质关系以及学生读图表提取信息能力,难度中等,旨在考查学生对知识的掌握与利用.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号)。
| A.氯化钙受热挥发 | B.氯化钙受热分解 |
| C.钙离子中电子跃迁 | D.氯离子中电子跃迁 |

①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 。
②胆矾晶体CuSO4·5H2O可以写出[Cu(H2O)4]SO4·H2O,其中中心原子(离子)是 ,配体是 ,配位原子是 ,配位数是 。
③铜离子形成胆矾中配位离子的离子方程式为 。
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因 。

 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.
