题目内容
NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、5.6 g 铁在足量氯气中燃烧,电子转移0.2NA个 |
| B、在常温常压下,11.2L氮气所含有的原子数目为NA |
| C、标准状况下,2.24 L SO3中含有0.1NA个水分子 |
| D、500mL 0.5mol/LAl2(SO4)3溶液中,SO42-的浓度为1.5mol/L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.铁与氯气反应生成氯化铁,0.1mol铁完全反应失去0.3mol电子;
B.常温常压下,不是标况下,不能使用标况下的气体摩尔体积计算氮气的物质的量;
C.标准状况下,三氧化硫的状态不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的物质的量;
D.根据硫酸铝的化学式、浓度计算出硫酸根离子的物质的量浓度.
B.常温常压下,不是标况下,不能使用标况下的气体摩尔体积计算氮气的物质的量;
C.标准状况下,三氧化硫的状态不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的物质的量;
D.根据硫酸铝的化学式、浓度计算出硫酸根离子的物质的量浓度.
解答:
解:A.5.6g铁的物质的量为0.1mol,0.1mol铁与足量氯气完全反应失去0.3mol电子,电子转移0.3NA个,故A错误;
B.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氮气的物质的量,故B错误;
C.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算2.24L三氧化硫的物质的量,故C错误;
D.0.5mol/LAl2(SO4)3溶液中,SO42-的浓度为:0.5mol/L×3=1.5mol/L,故D正确;
故选D.
B.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氮气的物质的量,故B错误;
C.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算2.24L三氧化硫的物质的量,故C错误;
D.0.5mol/LAl2(SO4)3溶液中,SO42-的浓度为:0.5mol/L×3=1.5mol/L,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项A为易错点,注意铁与氯气反应生成氯化铁.

练习册系列答案
相关题目
恒温下,将1mol N2和3mol H2在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s时测得NH3的体积分数为25%.则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2 mol?L-1?s-1 |
| B、2 s时N2的转化率为40% |
| C、2 s时混合气体中n(N2)?n(H2)?n(NH3)=3:9:4 |
| D、2 s 时NH3的浓度为0.4 mol?L-1 |
下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
| A、Na和O2 |
| B、NaOH和CO2 |
| C、NaAlO2和盐酸 |
| D、AlCl3和氨水 |
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN═CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
| A、CO为氧化产物,H2为还原产物 |
| B、CaCN2中含有非极性键 |
| C、HCN既是氧化剂又是还原剂 |
| D、每消耗10g CaCO3生成2.24L CO2 |
下列不属于硅酸盐产品的是( )
| A、水泥 | B、砖瓦 | C、陶瓷 | D、硫酸 |
下列说法正确的是( )
| A、向0.01 mol?L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小 | ||
| B、将水加热,KW增大,pH不变,仍呈中性 | ||
| C、向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变 | ||
D、c(H+)=
|
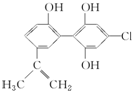 禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )
禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )| A、1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH |
| B、1 mol X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、X遇FeCl3溶液显色,可看作酚类物质 |
| D、兴奋剂X所有碳原子有可能共平面 |