题目内容
4.下列各种说法中正确的是( )| A. | 凡是能起银镜反应的物质一定是醛 | |
| B. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸 | |
| D. | 在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯 |
分析 A.含-CHO的有机物可发生银镜反应;
B.乙烯中含碳碳双键,甲苯中甲基易被氧化;
C.苯酚中不含-COOH;
D.酯化反应中,羧酸脱-OH,醇脱H.
解答 解:A.含-CHO的有机物可发生银镜反应,如醛、HCOOH、甲酸某酯、葡萄糖等均能起银镜反应,故A错误;
B.乙烯中含碳碳双键,甲苯中甲基易被氧化,均能被高锰酸钾氧化,则乙烯和甲苯都能使酸性高锰酸钾溶液褪色,故B正确;
C.苯酚中不含-COOH,则苯酚有弱酸性,俗称石炭酸,但不是羧酸,故C错误;
D.酯化反应中,羧酸脱-OH,醇脱H,生成水和酯,故的错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的反应等为解答的关键,综合性较强,题目难度不大.

练习册系列答案
相关题目
14.某MCFC型塑料电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为氢气,电解质为熔融的K2CO3.该电池的总反应式为:2H2+O2=2H2O,负极反应为:H2+CO32--2e-=H2O+CO2.则下列推断中,正确的是( )
| A. | 通入氢气的一极为电池的正极 | |
| B. | 当电池中生成1 mol水时,转移4 mol电子 | |
| C. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| D. | 放电时CO32-向负极移动 |
15.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Z位于元素周期表第三周期第ⅥA族,Y的氢化物空间构型是V形.
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)XZ4分子中X以sp3方式杂化.
(4)写出W元素的原子核外电子排布式1s22s22p63s23p63d104s1.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)XZ4分子中X以sp3方式杂化.
(4)写出W元素的原子核外电子排布式1s22s22p63s23p63d104s1.
12.下列说法正确的是( )
| A. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| B. | 2Na2O2+2H2O═4NaOH+O2↑,Na2O2是氧化剂H2O是还原剂 | |
| C. | Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Na2O2用作呼吸面具的供氧剂时氧元素既被氧化又被还原 |
19.沸点最低的一种烷烃x和它的同系物y以2﹕1的摩尔比混合,混合气的密度与x相邻同系物相等,则y的结构式可能是( )
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3CH2CH (CH3)2 | D. | CH3CH (CH3)2 |
16.某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
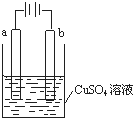

| A. | 若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-═Cu | |
| B. | 若a和b为铜,通电后a电极有气体产生 | |
| C. | 若a为铜,b为铁,通电后Cu2+向a电极移动 | |
| D. | 若a为粗铜,b为纯铜,通电后b电极质量增加 |
13.某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用图1的实验装置制取干燥纯净的氯气

①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为a、e、d、b、c、g、f(填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进?在C后接NaOH溶液尾气处理装置
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:FeCl3;假设③:FeCl3和FeCl2.
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论
如下表,请在表格内的横线处填空.
由此得出结论:假设①成立(填序号①②③).
(3)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如图2的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极析出Cu 3.2g时,停止通电,此时阳极产生氧气的体积(标准状况)为1.12L(假设气体全部逸出).
(1)用图1的实验装置制取干燥纯净的氯气

①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为a、e、d、b、c、g、f(填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进?在C后接NaOH溶液尾气处理装置
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:FeCl3;假设③:FeCl3和FeCl2.
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论
如下表,请在表格内的横线处填空.
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含FeCl2 |
(3)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如图2的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极析出Cu 3.2g时,停止通电,此时阳极产生氧气的体积(标准状况)为1.12L(假设气体全部逸出).

 .
.